
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y2W3
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. W与X形成的化合物只含离子键
【答案】A
【解析】试题分析:W、X、Y、Z为短周期元素,W、Z同主族,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,故W、Z为非金属,原子序数Z>W,W处于第二周期,Z处于第三周期,X、Y、Z同周期,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,则原子序数Y>X,且二者处于第三周期,X、Y、Z的原子序数Z>Y>X。A.W、Z同主族,原子序数Z>W,X、Y、Z同周期,X、Y、Z的原子序数Z>Y>X,所以原子半径X>Y>Z>W,正确;B.若W为N元素,Y为Mg元素,二者的原子序数相差5,二者形成化合物的化学式可能为Mg3N2,为Y3W2,错误;C.W的气态氢化物为氨气、水、氟化氢时,分子间存在氢键,沸点高于同族其它氢化物的沸点,W为C、Z为Si时,W氢化物沸点较低,错误;D.若W与X形成的化合物为过氧化钠,既含离子键又含共价键,错误。
考点:考查元素周期表、元素周期律的应用的知识。
【题型】选择题
【适用】一般
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
气相直接水合法制乙醇的方程式为:C2H4 (g)+H2O(g)=C2H5OH(g),其中乙烯的平衡转化率与温度、压强的关系如图[起始n(H2O)︰n(C2H4)=1︰1]。
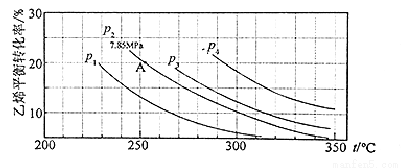
计算乙烯水合制乙醇反应在图中A点的平衡常数KP为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
A.0.068 MPa-1 B.0.082 C.0.072 MPa-1 D.0.082 MPa-1
科目:高中化学 来源:2015-2016学年江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有机物可以形成顺反异构的是( )
A.丙烯
B.2-甲基-2-丁烯
C.1-氯-1-丙烯
D.2,3-二甲基-2-丁烯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省怀化市高一下学期期末考试化学试卷(解析版) 题型:选择题
在元素周期表中,同主族元素原子具有相同的
A. 电子层数 B. 核电荷数
C. 核外电子数 D. 最外层电子数
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
下列各组性质的比较中,不正确的是
A. 碱性:NaOH>Mg(OH)2
B. 热稳定性:HCl>HBr
C. 失电子能力:K>Na
D. 原子半径:Cl>S
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:实验题
I、向草酸(H2C2O4)溶液中滴加硫酸酸化高锰酸钾溶液,研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 。
II、某同学根据外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,
实验过程的数据记录如下表,请结合表中信息,回答有关问题:
实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/ml | c/mol·L-1 | V/ml | c/mol·L-1 | V/ml | ||
A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(1)写出上述反应的离子方程式 。
(2)①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是 。
(3)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因: 。
【答案】I、5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+10CO2↑+8H2O ;
II、(1)S2O32-+2H+═S↓+SO2+H2O;(2)BD ;浓度对反应速率的影响;
(3)二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较。
【解析】
试题分析:I、草酸具有还原性,酸性高锰酸钾溶液具有强的氧化性,会把草酸氧化为CO2,高锰酸钾被还原草酸Mn2+,根据电子守恒机原子守恒,可得向(H2C2O4)溶液中滴加硫酸酸化高锰酸钾溶液,发生反应的化学方程式为5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+10CO2↑+8H2O;II、(1)硫代硫酸钠与硫酸发生反应产生硫酸钠、二氧化硫、硫单质及水,反应的离子方程式是S2O32-+2H+═S↓+SO2+H2O;(2)①能说明温度对该反应速率影响的实验应该是其它条件相同,只有反应的温度不相同,组合比较合理的是BD;②A和B、A和C的组合中其它条件相同,只有物质的浓度不相同,因此比较所研究的问题是浓度对反应速率的影响;(3)由于S是不溶于水的物质,所以教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢;由于二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较。
考点:考查氧化还原反应方程式的书写、离子方程式的书写、反应条件的控制及化学实验方案的设计与评价的知识。
【题型】实验题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
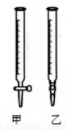
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) 。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视 。判断到达滴定终点的现象是:锥形瓶中溶液 。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
通过计算可得,该盐酸浓度为:______ mol•L-1(计算结果保留4位小数)
II、利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤1:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤2:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤:1相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
则BaCl2溶液浓度为______________________ mol·L-1。若步骤2中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
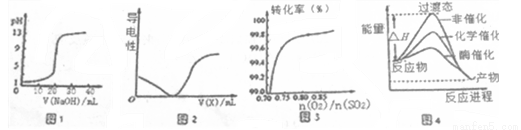
A.图一表示0.1000mol·L-1NaOH溶液滴定20.00ml 0.1000 mol·L-1醋酸溶液得到滴定曲线
B.图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2
C.图3在其它条件不变时,2SO2(g)+O2(g)  2SO3(g)转化关系中,纵坐标表示O2的转化率
2SO3(g)转化关系中,纵坐标表示O2的转化率
D.由图4所示曲线可知,酶催化比化学催化的效果好
【答案】D
【解析】
试题分析:A.醋酸是弱酸,0.1mol/L的醋酸的pH>1,所以图一表示0.1000mol·L-1NaOH溶液滴定20.00ml 0.1000 mol·L-1一元强酸溶液得到滴定曲线,错误;B.在H2S的溶液中通入Cl2,会发生反应:Cl2+H2S=S↓+2HCl,溶液的酸性增强,离子浓度增大,溶液的导电性增强,与图像不吻合,错误;C.2SO2(g)+O2(g)  2SO3(g)是可逆反应,在其它条件不变时,增大氧气的浓度,化学平衡正向移动,但是O2的转化率会降低,不符合图像,错误;D.催化剂可以降低反应的活化能,使反应速率加快,反应需要的活化能越低,反应速率就越快。根据图示可知酶催化比化学催化的效果好,正确。
2SO3(g)是可逆反应,在其它条件不变时,增大氧气的浓度,化学平衡正向移动,但是O2的转化率会降低,不符合图像,错误;D.催化剂可以降低反应的活化能,使反应速率加快,反应需要的活化能越低,反应速率就越快。根据图示可知酶催化比化学催化的效果好,正确。
考点:考查图像方法在溶液的导电性、化学反应及催化剂的作用比较的应用的知识。
【题型】选择题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
已知:① 2CO(g)+O2(g) 2CO2(g) △H=-566kJ/mol;
2CO2(g) △H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是

A.CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g
B.如上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D.CO的燃烧热为-566 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
X和Y两种元素可以形成XY2型共价化合物,则X和Y的原子序数为
A.3和17 B.6和8 C.12和9 D.8和16
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
理想的“原子经济”是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)
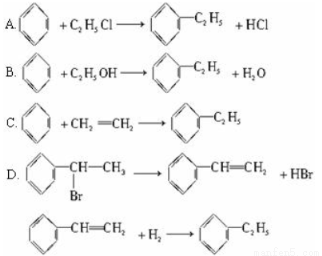
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
下列物质不能与乙烯发生加成反应的是( )
A.溴水 B.水 C.氢气 D.酸性高锰酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com