
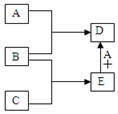
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).分析 A、B、C、D、E均为中学化学中常见物质,
①A常温下为黄绿色的气体单质,则A为Cl2;
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化,为Fe;
A和B反应生成D为FeCl3;
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素,C能和Fe反应生成E,E和氯气反应生成D,所以C为HCl、E为FeCl2,再结合题目分析解答.
解答 解:A、B、C、D、E均为中学化学中常见物质,
①A常温下为黄绿色的气体单质,则A为Cl2;
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化,为Fe;
A和B反应生成D为FeCl3;
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素,C能和Fe反应生成E,E和氯气反应生成D,所以C为HCl、E为FeCl2,
(1)A的名称为氯气,构成非金属单质A的元素的最高价氧化物中O为-2价、Cl元素化合价为+7价,所以该分子式为Cl2O7,故答案为:氯气;Cl2O7;
(2)氯气和水反应生成强电解质HCl、弱电解质HClO,且该反应是可逆反应,则A与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
(3)氯化亚铁和氯气发生氧化还原反应生成氯化铁,所以A与E反应生成D的化学方程式为2FeCl2+Cl2=2FeCl3,
故答案为:2FeCl2+Cl2=2FeCl3;
(4)E是氯化亚铁,氯化亚铁和NaOH反应先生成白色沉淀氢氧化亚铁,立即转化为灰绿色,最终生成红褐色氢氧化铁沉淀,所以看到的现象是:先生成白色沉淀、立即转化为灰绿色、最终生成红褐色沉淀,
故答案为:先生成白色沉淀、立即转化为灰绿色、最终生成红褐色沉淀.
点评 本题以铁及其化合物之间的转化为载体考查无机物推断,侧重考查学生分析推断能力,明确常见物质的特殊性质及特殊颜色是解本题关键,以氯气颜色、变价金属为题眼进行推断,题目难度不大.


科目:高中化学 来源: 题型:解答题
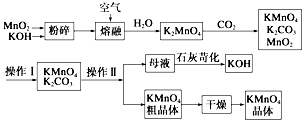
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尽可能使用稀溶液 | B. | 选择合适的催化剂 | ||
| C. | 碾细固体反应物 | D. | 提高反应体系的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
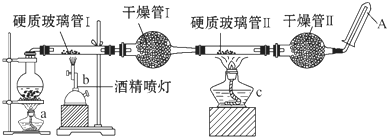 在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物
在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物查看答案和解析>>
科目:高中化学 来源: 题型:解答题
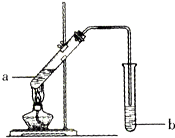 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com