


 HS-+OH-,则溶液呈碱性,
HS-+OH-,则溶液呈碱性, HS-+OH-;
HS-+OH-;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在PCl5分子中,磷分子满足最外层8电子结构 |
| B、凡中心原子采取sp3杂化的分子中,其分子几何构型都是四面体 |
| C、在NaCl晶体中,每个Na+的周围有6个Cl- |
| D、sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

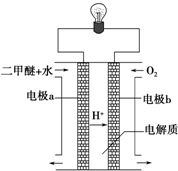


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+
| ||
| B、金属的化学腐蚀的实质是:M-ne-=Mn+,电子直接转移给氧化剂 | ||
| C、金属的化学腐蚀必须在酸性条件下进行 | ||
| D、在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol铁与1mol Cl2充分反应,转移电子数为3NA |
| B、常温常压下,22.4L NH3所含的分子数为NA |
| C、常温下,44g CO2中含有2NA个C=O键 |
| D、1mol/L的A1C13溶液中,Al3+离子的数目略小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com