
���� ��1�����ڷ�Ӧ����ʧ��������ԭ����
��2���ƺ�ˮ��������Ӧ��������ʱҪ����ˮ��������
��3���ƺ�ˮ��Ӧ�����������ƺ�������
��4����������ˮ��Ӧ�����������ƺ������ķ���ʽ��Ԫ�صĻ��ϼ۵ı仯�����ϼ����ߵ���Ԫ�ص�ԭ��ʧȥ���ӣ����ϼ۽��͵���Ԫ�ص�ԭ�ӵõ����ӣ���ʧ������Ŀ��ȣ������ŷ��������ת�Ƶķ������Ŀ���ɣ�
��5������������ת�Ƶ���֮��Ĺ�ϵʽ�������������
��� �⣺��1�����������1�����ӣ��������ڷ�Ӧ����ʧ��������ԭ�������ֻ�ԭ�ԣ��ʴ�Ϊ��ʧ����ԭ��
��2���ƺ�ˮ��������Ӧ��������ʱҪ����ˮ���������Ƶ��ܶȴ���ú���ܶ��Һ�ú�Ͳ���Ӧ������������ͨ��������ú���У��ʴ�Ϊ��ú�ͣ�
��3���ƺ�ˮ��Ӧ�����������ƺ���������Ӧ����ʽΪ��2Na+2H2O=H2��+2NaOH��
�ʴ�Ϊ��2Na+2H2O=H2��+2NaOH��
��4������ˮ��Ӧ�����������ƺ�����2Na+2H2O�T2NaOH+H2���������ӷ�ӦΪ2Na+2H20�T2Na++2OH-+H2�����÷�Ӧ����ʧȥ����0��+1����õ�����+1��0��ת��2e-��
�����ű������ת�Ƶķ������ĿΪ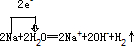 ��
��
�ʴ�Ϊ��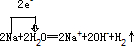 ��
��
��5�����������������Ϊx��
2Na+2H2O=H2��+2NaOHת�Ƶ���
22.4L 2mol
x 0.2mol
x=$\frac{22.4��0.2}{2}$=2.24L��
�ʴ�Ϊ��2.24L��
���� ���⿼���Ƶ����ʣ�������ԭ�ӵ��������ӷ��������ʣ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʢ�����������ı������м�Ũ���ᣬ���裬�����ף�������Ũ�������ˮ�� | |
| B�� | ��ҵ��ʹ�����۳�����Ũ���ᣬ������Ũ�����ǿ������ | |
| C�� | Ũ������ľ̿�ڼ��������·�Ӧ��������Ũ�����ǿ�����Ժ����� | |
| D�� | �ò�����պȡŨ������ڰ�ֽ�ϣ���ֽ��ڣ�������Ũ�������ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NaOH��Һ��ͨ�����CO2���壺2OH-+CO2�TCO32-+H2O | |
| B�� | NH4Al��SO4��2��Һ�еμ�������NaOH��Һ��NH4++OH-�TNH3•H2O | |
| C�� | ��NaClO��Һ��ͨ������SO2���壺ClO-+SO2+H2O�TSO42-+Cl-+2H+ | |
| D�� | 2 mol•L-1��NaAlO2��Һ��5 mol•L-1��������Һ�������Ͼ��ȣ�2AlO2-+5H+�TA1��OH��3��+Al3++H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol•L-1 | B�� | 0.12mol•L-1 | C�� | 0.05mol•L-1 | D�� | 0.16mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ���� | B�� | �ữ��FeSO4��Һ | C�� | Na2SO3��Һ | D�� | Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ϊ0.1 mol���ǻ���-OH����OH-�к��еĵ�����Ŀ��Ϊ0.9NA | |
| B�� | ��״���£�22.4 L O2��44.8 L SO2��ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ4NA | |
| C�� | ��Ϊ0.1 mol���ǻ���-OH����OH-�к��еĵ�����Ŀ��Ϊ0.9NA | |
| D�� | 1L 0.1 mol/L��NaClO��Һ�к��е�ClO-������ĿС��0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com