
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
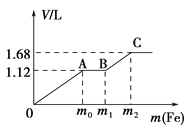
A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 参加反应铁粉的总质量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
【答案】C
【解析】
已知氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,据此答题。
A.开始时产生的气体为NO,故A错误;
B.AB段发生:Fe+2Fe3+═3Fe2+,为化合反应,故B错误;
C.最终生成Fe2+,根据氧化还原反应中得失电子数目相等可知3×n(NO)+2×n(H2)=2n(Fe),即3×0.05mol+2×![]() =2n(Fe),n(Fe)=0.1mol,质量为5.6g,故C正确;
=2n(Fe),n(Fe)=0.1mol,质量为5.6g,故C正确;
D.n(NO)=![]() =0.05mol,则所用混合溶液中c(HNO3)=
=0.05mol,则所用混合溶液中c(HNO3)=![]() =1mol/L,故D错误。
=1mol/L,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】中国科学院科学家团队通过镁热还原法将天然的硅藻土转化为具有多级孔道结构的硅框架,并将该硅框架与熔融态的锂金属混合制成具有多孔结构的复合锂金属。一种全固态锂金属电池是以复合锂金属为a极,磷酸铁锂为b极,聚环氧乙烷基聚合物(PEO-SPE)为固态电解质(如图所示),该电池的总反应为:LiFePO4![]() xLi+Li1-xFePO4。下列说法不正确
xLi+Li1-xFePO4。下列说法不正确
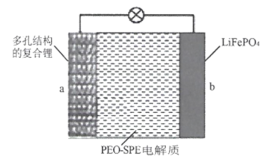
A.放电时Li+通过固态电解质向b极移动
B.多孔结构的复合锂金属有利于锂金属的均匀沉积和脱出
C.充电时,b极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4
D.充电时,当a极质量增加mg时,理论上b极质量减少mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
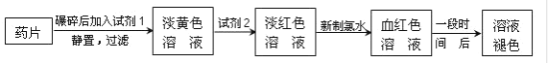
试回答下列问题:
(1)试剂1是__,试剂2是__,加入新制氯水后溶液中发生的离子反应方程式是__、_____。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__,写出+2价Fe在空气中转化为+3价Fe的化学方程式__。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?__。若你认为合理,请说明理由(若你认为不合理,该空不作答);若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油化工最重要的基础原料,请根据以下框图回答:
![]()
(1)以石油为原料的系列化工生产过程中,得到大量汽油、柴油等产品的主要方法是_______(选填序号)。
a. 水解 b. 分馏 c. 裂解 d. 裂化
(2)有机物A俗称酒精,含有的官能团名称是_________________.
(3)B的分子式为C2H4O2,与纯碱反应能生成二氧化碳气体,写出反应A+B→C的化学方程式________________ (有机物用结构简式表示),该反应类型为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,根据如图以氟碳铈矿为原料提取铈的工艺流程图,回答问题:
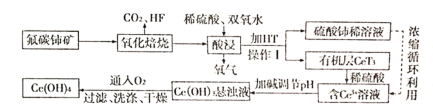
(1)CeFCO3中Ce的化合价为_____;氧化焙烧时不能使用陶瓷容器,原因是______。
(2)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为_________。
(3)HT是一种难溶于水的有机溶剂,则操作I的名称为________。
(4)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是__________。
(5)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:Ce3+(水层)+3HT(有机层)![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:________。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:________。
(7)298K时,向c(Ce3+)=0.02 mol/L的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?______。(要求列式计算,已知:Ksp[Ce(OH)3]=1.0×10-20,c(Ce3+)<1.0×10-5 mol/L视为沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
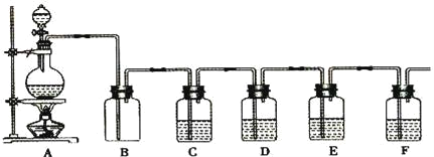
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O ![]() H+ + OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.25℃时水的电离程度大于35℃时水的电离程度
D.水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com