
分析 根据n=$\frac{V}{{V}_{m}}$、m=nM计算出氯化氢的物质的量、质量;将其溶于水配成100mL的溶液,根据c=$\frac{n}{V}$计算出所得溶液中氯化氢的物质的量浓度.
解答 解:标准状况下4.48L HCl的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量为:36.5g/mol×0.2mol=7.3g,
将0.2molHCl溶于水配成100mL溶于,所得溶液的浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:7.3;2.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、物质的量浓度、气体摩尔体积之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 改用98%的浓硫酸 | ||
| C. | 改用锌粒 | D. | 滴加少量CuSO4溶液 |
查看答案和解析>>
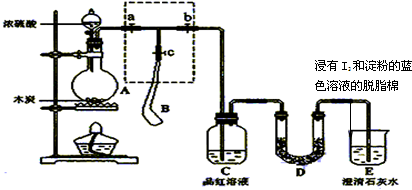
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 现象 |
| Ⅰ | 把氯水点在蓝色石蕊试纸上 | 试纸先变红后褪色 |
| Ⅱ | 向氯水中滴加足量AgNO3溶液,不断振荡 | ⅰ.有白色沉淀生成 ⅱ.稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、
、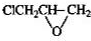 .
. 分子式相同,且能使氯化铁溶液显紫色的同分异构体还有11种(不考虑立体异构),其中核磁共振氢谱为4组峰,且峰的面积比为2:2:1:3的结构简式(写出其中任意两种)是
分子式相同,且能使氯化铁溶液显紫色的同分异构体还有11种(不考虑立体异构),其中核磁共振氢谱为4组峰,且峰的面积比为2:2:1:3的结构简式(写出其中任意两种)是 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(H+)=1×10-12mol•L-1的溶液:Mg2+、SO42-、NO3-、Cl- | |
| B. | 含有大量Fe3+的溶液:K+、Na+、AlO2-、SO42- | |
| C. | 能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3- | |
| D. | 含有大量S2-的溶液:Na+、ClO-、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com