
【题目】某探究小组在某温度下测定溶液的pH时发现0.01mol/L 的NaOH溶液中,由水电离出的c(H+)c(OH-)=10-22,该探究小组将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:10混合,混合后所得溶液恰好呈中性,若x=![]() y,则x为( )
y,则x为( )
A.2B.3C.4D.5
科目:高中化学 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用外科口罩中过滤层所用材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用,口罩生产中还需使用环氧乙烷进行灭菌。下列说法正确的是
A.熔喷聚丙烯的链节为CH2=CHCH3
B.熔喷聚丙烯可以使溴的四氯化碳溶液褪色
C.废弃的医用外科口罩属于可回收垃圾
D.2CH2=CH2+O2![]() 2
2 是一种最理想的“原子经济性反应”
是一种最理想的“原子经济性反应”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上处理含苯酚废水的过程如下。回答下列问题:
I.测定废水中苯酚的含量。
测定原理:![]() +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr
测定步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.00mLamol/L浓溴水(过量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入bmL0.10mol/LKI溶液(过量),塞紧瓶塞,振荡。
步骤4:以淀粉作指示剂,用0.010mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V1mL。(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
把待测废水换为蒸馏水,重复上述各步骤(即进行空白实验),消耗Na2S2O3标准溶液V2mL(以上数据均已扣除干扰因素)。
(1)步骤1中量取待测废水所用仪器是_________。
(2)步骤2中塞紧瓶塞的原因是_________。
(3)步骤4中滴定终点的现象为_________。
(4)该废水中苯酚的含量为_________mg/L(用含V1、V2的代数式表示)。
(5)如果“步骤4”滴定至终点时仰视读数,则测得消耗Na2S2O3标准溶液的体积_____V1mL(填“偏大”、“偏小”或“无影响”,下同);如果空白实验中的“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量_________。
II.处理废水。
采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(OH),阴极上产生H2O2。通过交替排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(6)写出阳极的电极反应式:_________。
(7)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物 E 是合成某种香料的中间体 ,以苯为原料合成 E 流程如下 :

已知:CH3Br![]() CH3 MgBr
CH3 MgBr  CH3CH 2CH2OH;
CH3CH 2CH2OH;
![]()
![]()
![]()
(1)写出反应①所需的试剂和条件______;
(2)化合物A中碳原子的杂化类型为_____, 分子中不同化学环境的氢原子共有___种;
(3)D中含氧官能团的名称为______;
(4)写出反应⑨的化学方程式_____,该反应的反应类型为_____;
(5)化合物C能与Na2CO3溶液反应生成CO2,符合以下 a 、b 、c、d条件的C的同分异构体与足量NaOH溶液反应的化学方程式___;
a.属于芳香族化合物 b.能发生银镜反应,也能发生水解反应 c. 结构中存在乙基 d苯环上的一氯代物只有 2 种
(6)以![]() 为主要原料,合成
为主要原料,合成 的流程为_________。
的流程为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块(NaHSO2HCHO2H2O,次硫酸氢钠甲醛)是易溶于水的白色块状或结晶性粉状固体,在印染工业中被用作拔染剂和还原剂。可由Na2S2O5 (焦亚硫酸钠)、甲醛及锌粉反应制取,回答下列问题:
(1)已知在pH=4.1时的过饱和NaHSO3溶液将自动脱水生成Na2S2O5,制备原料Na2S2O5的装置如下。

①通入H2的目的是______。
②吸滤瓶中先后发生的反应为_______、2NaHSO3=Na2S2O5↓+H2O。
③从环境保护和安全考虑,下列尾气处理方法正确的是________(填标号)。
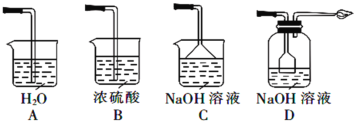
④实验室用稀NaOH溶液不能制得Na2S2O5,是因为_______。
(2)制备吊白块的装置(夹持及加热装置已略)如图:
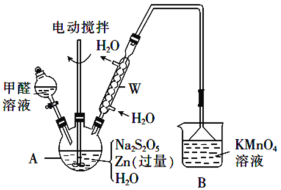
①仪器A的名称是_________。
②制备反应需在950C下进行,合适的加热方式是_____,A中发生反应的化学方程式为_____(Zn转化为等物质的量的ZnO和Zn(OH)2)。
③从A中的悬浊液中得到产品吊白块的实验操作是_________及干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________,Ag+的价电子排布式为_________。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ/mol | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。
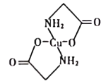
①配合物中碳原子的轨道杂化类型为_________。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________个;该晶体的化学式为_________。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为_________pm(1pm=10-12m,只写计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com