
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:分析 (1)根据价层电子对互斥理论确定N、S原子杂化方式及SO42-的空间构型;
(2)Ca原子的M能层有8个电子和N能层有2个电子;
(3)根据电负性以及成键电子对的排斥作用分析;
(4)离子半径越小,电荷越多,离子晶体的晶格能越大,熔沸点越高;
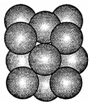
(5)由晶胞图可知,该晶体中原子的堆积方式为面心立方最密堆积,其配位数为12;设其变长为acm,则a2+a2=(4r×10-10)2,V=a3,ρ=$\frac{m}{V}$.
解答 (1)(NH4)2SO4中铵根离子中N原子价层电子对个数是4、SO42-中S原子价层电子对个数是4,所以N、S原子杂化方式都是sp3杂化,SO42-中S原子价层电子对个数是4,没有孤电子对,则应为正四面体结构;
故答案为:sp3、sp3;正四面体;
(2)Ca原子的M能层有8个电子和N能层有2个电子,M层排满应该是18个电子,N层排满应该是32个电子,所以没有排满的电子层为M能层和N能层;
故答案为:M能层和N能层;
(3)已知元素的非金属性N>P,非金属性越强,其电负性越强,则中心原子的电负性N>P,N的电负性较强吸引电子能力较强,使得NH3中成键电子对偏向中心N原子,成键电子对间产生的斥力增大,键角增大,所以键角NH3>PH3;
故答案为:NH3>PH3;中心原子的电负性N>P,使得NH3中成键电子对偏向中心N原子,成键电子对间产生的斥力增大,键角增大;
(4)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与晶格能有关,离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO,
故答案为:r(Ni2+)<r(Fe2+);NiO、FeO都是离子晶体,熔点NiO>FeO,NiO的离子键能较大,阴离子相同,且阴、阳离子所带电荷数相同,所以r(Ni2+)<r(Fe2+);
(5)由晶胞图可知,该晶体中原子的堆积方式为面心立方最密堆积,其配位数为12;
设其变长为acm,则a2+a2=(4r×10-10)2,V=a3=(2$\sqrt{2}$r×0-10)3,
晶胞中原子数为$\frac{1}{2}$×6+$\frac{1}{8}$×8=4,晶胞的质量为m=$\frac{4M}{{N}_{A}}$,
所以ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}×1{0}^{-10})^{3}}$;
故答案为:$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}×1{0}^{-10})^{3}}$.
点评 本题考查了物质结构与性质,涉及核外电子排布、晶格能的比较、杂化类型的判断、晶体性质、晶胞的计算等,旨在考查学生对基础知识的掌握,侧重考查分析计算能力及空间想象能力,题目难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 生成淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 将澄清石灰水滴入可能混有Na2CO3的NaHCO3溶液中 | 有白色沉淀产生 | 该溶液中一定含有Na2CO3 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入Na2SiO3溶液中 | 硅酸钠溶液产生白色胶状物质 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
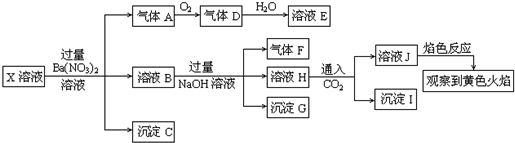
| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.
青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
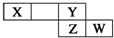 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>Z | |
| B. | Z的最高价氧化物对应水化物是强酸 | |
| C. | X元素的最简单氢化物与Y元素形成的化合物溶于水会促进水的电离. | |
| D. | 已知HY沸点远高于HZ,因为H-Y键的键能高于H-Z键. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为4OH-═O2+2H2O+4e- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1 mol水蒸气,转移电子4 mol | |
| D. | 氢氧燃料电池的H2和O2都贮存于电池中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
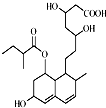 一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )
一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色,但能与FeCl3溶液发生显色反应 | |
| B. | 含有4种含氧官能团 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与5molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com