
| A. | v(A)=3.6mol/(L•s) | B. | v(B)=0.075mol/(L•s) | C. | v(C)=0.030mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
分析 v(A)=$\frac{0.9mol}{1L×30s}$=0.030mol/(L•s),根据化学反应速率之比等于化学计量数之比计算v(B)、v(C)、v(D).
解答 解:v(A)=$\frac{0.9mol}{1L×30s}$=0.030mol/(L•s),根据化学反应速率之比等于化学计量数之比可得:
v(B)=$\frac{5}{2}$×v(A)=2.5×0.030mol/(L•s)=0.075mol/(L•s),
v(C)=$\frac{4}{2}$×v(A)=2×0.030mol/(L•s)=0.060mol/(L•s),
v(D)=$\frac{6}{2}$×v(A)=3×0.030mol/(L•s)=0.090mol/(L•s),
故选B.
点评 本题考查了化学反应速率的计算,难度不大,注意化学反应速率之比等于化学计量数之比的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | c(Ca2+)增大 | ||
| C. | 溶液中c(OH-)不变 | D. | 溶液中OH-数目不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:4 | C. | 4:3 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
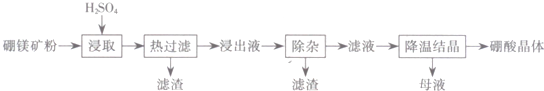
| 温度℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
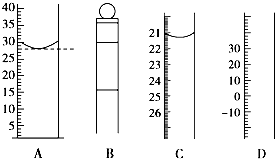 (1)图为常见仪器的部分结构(有的仪器被放大)
(1)图为常见仪器的部分结构(有的仪器被放大)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/mL | 测得生成沉淀的质量/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com