
| 选项 | 实验内容 | 实验现象 | 实验结论 |
| A | 将几滴水加入蔗糖中并搅拌,再加入浓硫酸,迅速搅拌 | 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 | 只体现了浓硫酸的脱水性 |
| B | 将铜片放入浓硝酸中 | 产生大量红棕色气体,溶液变为蓝绿色 | 体现了浓硝酸的强氧化性和酸性 |
| C | 溴乙烷和氢氧化钠溶液充分反应,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色下层有机层为橙红色 | 苯与溴发生了萃取作用 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.体积膨胀,发生C与浓硫酸的反应生成气体;
B.铜片放入浓硝酸中,反应生成硝酸铜、二氧化氮和水;
C.溴乙烷和氢氧化钠溶液发生水解反应,在酸性溶液中可检验溴离子;
D.苯的密度比水的密度小,有机层在上层.
解答 解:A.体积膨胀,发生C与浓硫酸的反应生成气体,由现象可知,体现了浓硫酸的脱水性、强氧化性,故A错误;
B.铜片放入浓硝酸中,反应生成硝酸铜、二氧化氮和水,则产生大量红棕色气体,溶液变为蓝绿色,可知浓硝酸的强氧化性和酸性,故B正确;
C.溴乙烷和氢氧化钠溶液发生水解反应,在酸性溶液中可检验溴离子,由生成淡黄色沉淀可知溴乙烷中含有溴元素,故C正确;
D.苯的密度比水的密度小,有机层在上层,则溴水褪色上层有机层为橙红色,故D错误;
故选BC.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、有机物的结构与性质、萃取等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 过量Ba(OH)2溶液与少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | |
| B. | 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| C. | 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| B. | 甲装置中阴极的反应为Fe-2e-═Fe2+ | |
| C. | 为了增加污水的导电能力,应向污水中如入适量的NaOH溶液 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +16.3 | B. | -16.3 | C. | +335.7 | D. | -335.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
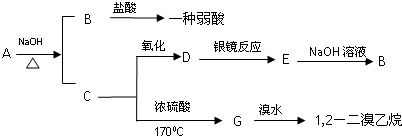
 2CH3CHO+2H2O.
2CH3CHO+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于硫酸氢钠溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com