
| 类 别 | 典型代表物名称 | 官能团名称 | 结构简式 |
| 醇 | 乙醇 | 羟基 | CH3CH2OH |
| 酚 | 苯酚 | 羟基 | 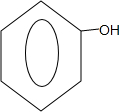 |
| 醛 | 乙醛 | 醛基 | CH3CHO |
| 羧酸 | 乙酸 | 羧基 | CH3COOH |
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 某酸雨试样中加入Ba(OH)2溶液 | 产生白色沉淀 | 酸雨试样中只含SO42- |
| C | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| D | 食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐含有KIO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水冷却到0℃以下时变成冰,是因为水分子从液体变成了固体 | |
| B. | 所有物质在温度变化时都能表现出三态变化 | |
| C. | 不降低温度,只增大压强,也可能使物质从气态变成固态 | |
| D. | 物质能热胀冷缩是因为构成物质的微粒能够热胀冷缩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
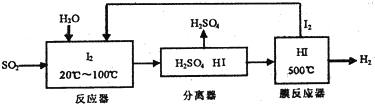
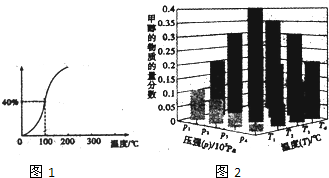
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
| C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
| D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
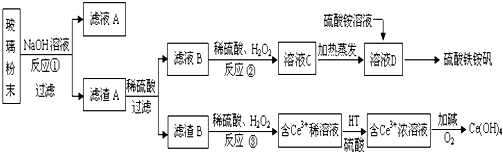
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
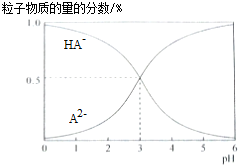
| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 芳香烃的分子通式是CnH2n-6 (n≥6) | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 苯和甲苯都不能使KMnO4酸性溶液褪色 | |
| D. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Fe2+、Zn2+ | C. | Fe2+、Ag+ | D. | Fe2+、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com