
【题目】如图所示为人体内不同化学元素所组成的化合物,以下说法错误的是

A. 若图中①为某种生物大分子的基本单位,则①最可能是氨基酸
B. 若②遇苏丹Ⅲ染液出现橘黄色,则②最可能是脂肪
C. 若③能储存和传递遗传信息,则③一定是 DNA
D. 若④是人和动物的储能物质且主要分布在人体肝脏和肌肉内,则④最可能是糖原
【答案】C
【解析】
分析题图:图示表示不同化学元素所组成的化合物,其中化合物①的组成元素为C、H、O、N,最可能是蛋白质或其基本组成单位氨基酸;化合物②的组成元素为C、H、O,最可能是糖类或脂肪;③的组成元素为C、H、O、N、P,最可能是核酸及其组成单位核苷酸以及ATP;化合物④的组成元素为C、H、O,最可能是糖类或脂肪。
①的组成元素为C、H、O、N,可能是蛋白质,若①为某种大分子的组成单位,则①最可能是蛋白质的组成单位氨基酸,A正确;②的组成元素为C、H、O,可能是糖类或脂肪,若②遇苏丹Ⅲ染液出现橘黄色,则②最可能是脂肪,B正确;③的组成元素为C、H、O、N、P,可能是核酸、核苷酸或ATP,核酸是遗传信息的携带者,核酸分为DNA和RNA,因此如果③为生物大分子,且能贮存生物的遗传信息,则③是DNA或者RNA,C错误;④的组成元素为C、H、O,可能是糖类或脂肪,若④主要分布在人体肝脏和肌肉内,则④最可能是糖原,D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。下列对实验现象的解释或推测不合理的是
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
A. a、d处:2H2O+2e-=H2↑+2OH-
B. b处:2Cl--2e-=Cl2↑,Cl2溶于水生成HClO,使溶液褪色
C. c处发生了反应:Fe-2e-=Fe2+
D. 根据实验一的原理,实验二中n处能析出O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示实验装置中,向盛有溶液①和溶液②的试管中,通入过量气体X,最终溶液①、溶液②均无沉淀生成的是:

选项 | 气体X | 溶液① | 溶液② |
A | SO2 | Ca(OH)2 | BaCl2 |
B | Cl2 | AgNO3 | Na2S |
C | NH3 | AgNO3 | AlCl3 |
D | HCl | Na2SiO3 | NaAlO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
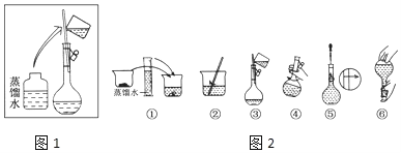
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃与溴化氢、水加成时,产物有主次之分,例如:
![]()

下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。

上述框图中,B的结构简式为________;属于取代反应的有__________(填框图中序号),属于消去反应的有__________(填序号);写出反应④的化学方程式(只写主要产物,标明反应条件):__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假定把![]() C的相对原子质量改为24,那么下列叙述错误的是
C的相对原子质量改为24,那么下列叙述错误的是
A. 此时16O的相对原子质量为32
B. NA个O2与NA个H2的质量比为16:1
C. N2的摩尔质量为56g/mol
D. 标准状况下,16g O2的体积约为5.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL 0.1mol/L的盐酸中逐滴加入0.2mol/L的氨水,溶液的pH与所加氨水的体积关系如图所示,下列说法正确的是

A. a、b、c三点比较,水的电离程度a点最大
B. 在c点:c(NH4+)+c(NH3·H2O)= 0.2mol/L
C. 在a点:c(OH-)<c(H+)<c(NH4+)<c(NH3·H2O)<c(Cl-)
D. 在b点,盐酸与氨水恰好完全中和, c(NH4+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO 和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知该转化反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH,则加快该反应的化学反应速率,应采用的有效措施有___________________________(填写两种)。
2CO(g)+2H2(g) ΔH,则加快该反应的化学反应速率,应采用的有效措施有___________________________(填写两种)。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。

①由图可知,该反应的ΔH_____0 (填写“大于”或者“小于”),P1、P2、P3、P4由大到小的顺序为_________________________。
②工业生产时一般会选用P4和1250℃进行合成,请解释其原因______________________________。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_________________mol·L-1·min-1。
④该温度下,反应的平衡常数K的数学表达式为K=_______,经计算K的数值为K=_____________(保留3位有效数字),若要使K减小可采取的措施是_________________。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是_______________
A. H2、CO和H2O的物质的量之比为1:1:1 B.体系压强不再变化
C. 气体平均相对分子质量不变 D.混合气体的密度保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向_______(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是


A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2 周围最近且等距离的CO2有8个
D.图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com