

| A. | 该中和滴定适宜用酚酞作指示剂 | |
| B. | 两者恰好中和时,溶液的pH=7 | |
| C. | 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-) |
分析 A.反应终点生成氯化铵,水解显酸性;
B.两者恰好中和时生成氯化铵;
C.物料守恒式为c(NH4+)+c(NH3•H2O)=c(Cl-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+c(Cl-);
D.溶液不显电性,遵循电荷守恒.
解答 解:A.反应终点生成氯化铵,水解显酸性,酚酞的变色范围为8~10,应选甲基橙作指示剂,故A错误;
B.两者恰好中和时生成氯化铵,溶液的pH<7,故B错误;
C.物料守恒式为c(NH4+)+c(NH3•H2O)=c(Cl-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(H+)=c(OH-)+c(NH3•H2O),故C正确;
D.溶液不显电性,遵循电荷守恒,则当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)=c(OH-)+c(Cl-),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断,为高频考点,把握滴定终点的酸碱性、电荷及物料守恒式为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | 结合质子能力:S2->Cl- | ||
| C. | 原子半径:Ge>As | D. | 酸性:HNO2>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(X) | c(Y) | c(Z) | c(Z) | ||
| I | 758 | 0.2 | 0.1 | 0 | 0.1 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器I中Z的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中Z的浓度为0.05 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中Z的浓度大于0.1 mol•L-1 | |
| D. | 若起始时向容器I中充入0.02 mol X、0.01 mol Y和0.02 mol Z,则反应向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含Ca2+数目为0.1NA | B. | Cl-的物质的量浓度为0.4mol•L-1 | ||
| C. | 含钙元素质量为4g | D. | 含CaCl2的质量分数为22.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| B. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| C. | R的单质在过量的O2中燃烧,可得到R的最高价氧化物 | |
| D. | 同周期元素形成的最简单氢化物中,X的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 镁粉/g | H2O/mL | NH4Cl溶液/mL | NH4NO3溶液/mL |
| ① | 5 | 0 | 20 | 0 |
| ② | 5 | 0 | 0 | 20 |
| ③ | 5 | 20 | 0 | 0 |
| 实验步骤(不要求写出具体操作过程): 增加一组镁与NaCl溶液的作用的实验 实验结论常温下镁几乎不和NaCl溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
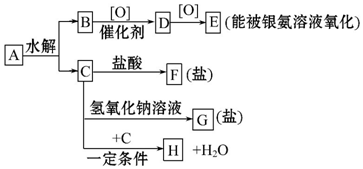
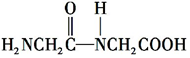 +H2O.
+H2O.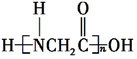 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
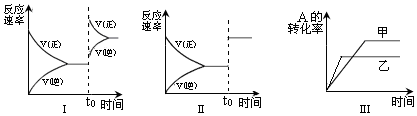
| A. | 图I研究的是t0时刻增大A的浓度对反应速率的影响 | |
| B. | 图II研究的是t0时刻加入催化剂或通入氦气使压强增大后对反应速率的影响 | |
| C. | 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图III研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com