
糖类物质为很多生物生命活动提供能量.
(1)已知 45g葡萄糖在人体内完全氧化为二氧化碳和水,放出701KJ的热量,该反应的热化学方程式 .
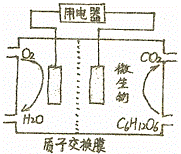
(2)以葡萄糖为燃料的微生物燃料电池结构如图所示,其负极反应为: .电池工作过程中溶液中氢离子移动方向从 极区移向 极区(填“正”或“负”)
(3)常温下,用上述电池惰性电极电解100L某浓的硫酸铜溶液,当溶液PH=1时停止电解,则理论上需要葡萄糖的质量为 (假设溶液体积不变)
考点: 原电池和电解池的工作原理;热化学方程式.
分析: (1)45g葡萄糖的物质的量为0.25mol,其完全氧化放热701KJ,则1 mol葡萄糖在体内完全氧化将放出热量2840kJ;
(2)燃料电池的构造为:燃料通入负极,氧气或空气通入正极;工作的过程中,阳离子移向正极,阴离子移向负极;
(3)电解100L某浓的硫酸铜溶液,当溶液PH=1时生成硫酸物质的量为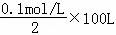 =5mol,据电解硫酸铜的化学方程式可知,每生成1mol硫酸转移2mo电子,根据电子守恒计算需要葡萄糖的质量.
=5mol,据电解硫酸铜的化学方程式可知,每生成1mol硫酸转移2mo电子,根据电子守恒计算需要葡萄糖的质量.
解答: 解:(1)45g葡萄糖的物质的量为0.25mol,其完全氧化放热701KJ,则1 mol葡萄糖在体内完全氧化将放出热量2840kJ,反应的热化学方程式为C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=﹣2804kJ/mol,故答案为:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g)△H=﹣2804kJ/mol;
(2)葡萄糖在负极失电子而被氧化,电极反应式为C6H12O6+6H2O﹣24e﹣=6CO2+24H+,原电池中阳离子从负极移向正极,
故答案为:C6H12O6+6H2O﹣24e﹣=6CO2+24H+;负;正;
(3)电解100L某浓的硫酸铜溶液,当溶液PH=1时生成硫酸物质的量为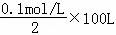 =5mol,据电解硫酸铜的化学方程式2CuSO4+2H2O
=5mol,据电解硫酸铜的化学方程式2CuSO4+2H2O 2Cu+O2↑+2H2SO4,可知,每生成1mol硫酸转移2mo电子,所以转移电子物质的量为10mol,据电极反应式C6H12O6+6H2O﹣24e﹣=6CO2+24H+可知,每转移24mol电子,需要葡萄糖的质量为180g,转移10mol电子,需要葡萄糖的质量为
2Cu+O2↑+2H2SO4,可知,每生成1mol硫酸转移2mo电子,所以转移电子物质的量为10mol,据电极反应式C6H12O6+6H2O﹣24e﹣=6CO2+24H+可知,每转移24mol电子,需要葡萄糖的质量为180g,转移10mol电子,需要葡萄糖的质量为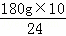 =75g,故答案为:75g.
=75g,故答案为:75g.
点评: 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:
下列说法正确的是()
A. 单位物质的量的气体所占的体积就是气体摩尔体积
B. 摩尔是物质的量的单位
C. 阿伏加德罗常数就是6.02×1023
D. CO2的摩尔质量为44g
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 3.6g重水中含有的中子数为2NA
B. 16.0g的过氧(根)离子中含有的电子数为9NA
C. 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA
D. 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是( )
A. Ca2+、Cl﹣、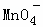 、Na+ B. K+、Cl﹣、
、Na+ B. K+、Cl﹣、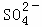 、H+
、H+
C. OH﹣、Na+、Al3+、I﹣ D. H+、Cl﹣、Ba2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. 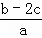 B.
B. 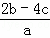 C.
C. 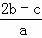 D.
D. 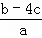
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是()
组别 c(HCl)(mol/L) 温度(℃) 状态
1 2.0 25 块状
2 2.5 30 块状
3 2.5 50 块状
4 2.5 30 粉末状
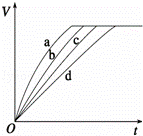
A. 4﹣3﹣2﹣1 B. 1﹣2﹣3﹣4 C. 3﹣4﹣2﹣1 D. 1﹣2﹣4﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1mol白磷转化成1mol红磷,放出18.39kJ热量,又知:P4(白,s)+5O2=2P2O5(s)△H1,4P(红,s)+5O2=2P2O5(s)△H2 则△H1和△H2的关系正确的是()
A. △H1>△H2 B. △H1<△H2 C. △H1=△H2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是()
A. 平衡向正反应方向移动 B. a<c+d
C. D的体积分数变大 D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下某密闭容器中,可逆反应A(g)+3B(g)⇌2C(g)+2D(s)达到平衡,下列描述一定正确的是( )
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④反应物的转化率不再变化
⑤混合气体的压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2.
|
| A. | ①②③④⑤⑥⑦ | B. | ①③④⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ①③⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com