
【题目】一定温度下,把6 mol A和5 mol B通入容积为4L的恒容密闭容器中发生反应3A(g)+B(g)![]() 2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是
2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是

A.t2=5min,平衡时3v正(A)=2v逆(D)
B.0~t2,A的平均反应速率为0.15 mol·L-1·min-1
C.t2~t3,各物质的浓度一定相等
D.B的平衡转化率为25%
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B.向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++OH-=NH3·H2O
C.向明矾溶液中加入Ba(OH) 2溶液至生成沉淀的物质的量最多:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水化学资源的利用具有非常广阔的前景。以海水为原料制备MgCl2和NaOH的工艺流程如下:
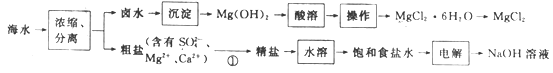
下列说法错误的是
A.“沉淀”时常用石灰乳作为沉淀剂
B.“酸溶”时加入过量盐酸,有利于得到MgCl2·6H2O晶体
C.“电解”时,NaOH在阴极区得到
D.过程①加入试剂的顺序依次为Na2CO3溶液、NaOH溶液、BaCl2溶液、稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(![]() ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
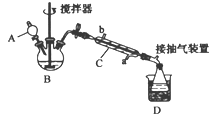
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是_______,仪器C中冷水流入口是_______ (填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是______________。
(3)生成过氧乙酸的化学方程式为_________________。
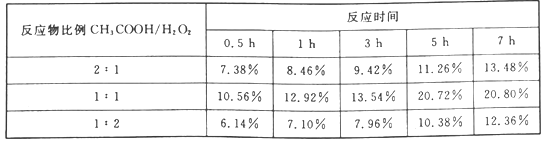
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_______,最佳反应时间约_______。
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。则产品中过氧乙酸的物质的量浓度是________mol·L-1 (保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,分别将充满下列气体的容器倒扣于水槽中(设气体不发生扩散),充分反应后,瓶内溶液的物质的量浓度不等于![]() molL﹣1(约0.045molL﹣1)的是( )
molL﹣1(约0.045molL﹣1)的是( )
A.HClB.NO2、O2C.SO2、N2D.NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com