
| A. | 铁 | B. | 钙 | C. | 氧 | D. | 溴 |
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
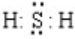 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
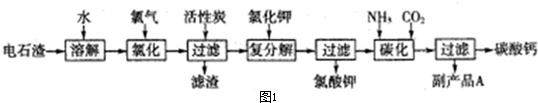
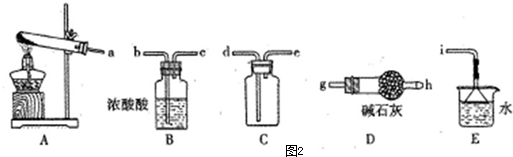
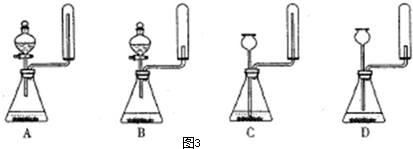
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
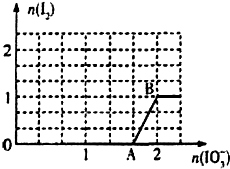 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com