
【题目】镁、钡是位于同一主族的活泼的金属元素。
回答下列问题:
(1)镁在元素周期表中的位置是:______________;钡位于周期表第六周期,钡原子最外层电子的电子排布式是:________。
(2)铝也是一种活泼金属,铝的金属性比钡的_____(填“强”或“弱”)。工业上可用如下方法制取钡:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,该法制钡的主要原因是______(选填选项)
3Ba↑+BaO·Al2O3,该法制钡的主要原因是______(选填选项)
a.高温时Al的活泼性大于Ba b.高温时BaO·Al2O3比Al2O3稳定
c.Ba的沸点比Al的低 d.高温有利于BaO分解
两个烧杯分别盛有VmL、c mol/L的Ba(OH)2溶液,分别向其中滴入c mol/L的H2SO4 和NaHSO4溶液,两烧杯中溶液导电能力随滴入溶液体积的变化分别如下图中①、②所示。
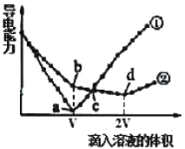
(3)写出Ba(OH)2溶液与H2SO4恰好反应的离子方程式:___________。
(4)写出b点溶液中大量存在的阴离子的电子式:_________。
(5)a、b、c、d点溶液呈中性的是____________________。
【答案】 第三周期、第ⅡA族 6s2 弱 c Ba2++2OH-+2H++SO42-→BaSO4↓+H2O ![]() a、d
a、d
【解析】试题分析:(1)根据元素周期表的结构分析;(2)根据元素性质递变规律分析;(3)根据高温条件下Al、Ba的状态回答;(3)Ba(OH)2溶液与H2SO4恰好反应生成硫酸钡和水;滴入vmL硫酸时曲线①导电性为0,说明滴入vmL硫酸时,氢氧化钡与硫酸的物质的量比为1:1
解析:(1)镁是12号元素,在元素周期表中的位置是第三周期、第ⅡA族;(2)同主族元素从上到下金属性增强,铝的金属性比钡的弱;镁、钡是位于同一主族,钡位于周期表第六周期,钡原子最外层有2个电子,最外层电子的电子排布式是6s2 ;(3)根据方程式,相同条件下Ba是气态,Ba的沸点比Al的低,所以可用2Al+4BaO=3Ba↑+BaO·Al2O3制钡 ;(3)Ba(OH)2溶液与H2SO4恰好反应生成硫酸钡和水,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ;(4)滴入vmL溶液时曲线①导电性为0,说明曲线①为滴入硫酸的曲线,滴入vmL硫酸时,氢氧化钡与硫酸恰好完全反应,硫酸与氢氧化钡的物质的量比为1:1;则曲线②为氢氧化钡中滴入NaHSO4的曲线,b点NaHSO4与氢氧化钡的物质的量比为1:1,反应方程式为NaHSO4+Ba(OH)2═BaSO4↓+H2O+NaOH,所以b点溶液中大量存在的阴离子是OH-,电子式为![]() ;(5)a点硫酸与氢氧化钡恰好完全反应溶液呈中性、c点硫酸过量,溶液呈酸性,b点生成氢氧化钠溶液呈碱性,d点NaHSO4与氢氧化钡的物质的量比为2:1,反应方程式为2NaHSO4+Ba(OH)2═BaSO4↓+2H2O+Na2SO4,溶液呈中性,故a、d两点溶液呈中性。
;(5)a点硫酸与氢氧化钡恰好完全反应溶液呈中性、c点硫酸过量,溶液呈酸性,b点生成氢氧化钠溶液呈碱性,d点NaHSO4与氢氧化钡的物质的量比为2:1,反应方程式为2NaHSO4+Ba(OH)2═BaSO4↓+2H2O+Na2SO4,溶液呈中性,故a、d两点溶液呈中性。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关生物体化学成分的叙述,正确的是( )
A. 精瘦肉中含量最多的是蛋白质
B. 组成细胞壁主要成分的单体是氨基酸
C. T2噬菌体的遗传物质含硫元素
D. 与精子形成相关的雄激素属于脂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是_______________,①的反应类型是_______________。
(2)B中含有的官能团是_______________(写名称),
(3)D聚合生成高分子化合物的化学方程式为________________。
(4)反应③的化学方程式是___________________。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为_________________。
(6)分子式C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有__________________种(不考虑立体异构)。
(7)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)。____________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法中正确的是
A. 在生产生活中比较普遍而且危害较大的是金属的化学腐蚀
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含最/mg·L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
利用电渗析法技术可将海水淡化,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。下列说法中不正确的是

A. 电解一段时阳后阴极区会发生反应:Ca2++OH-+HCO3-==CaCO3↓+H2O
B. 阳极的电极反应式为2H2O-4e-=O2+4H+
C. 电解时b室中阴离子移向a室,阳离子移向c室
D. 淡水的出口为b出口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成化合物D。
(1)易与C发生化学反应的酸是________,写出反应的化学方程式:_________________。
(2)C与纯碱混合高温熔融时生成D和气体E;将生成的全部气体E通入全部D溶于足量的水得到的溶液中,又发生化学反应生成化合物F。
①分别写出上述过程中,生成D和生成F的化学反应方程式:_____________、___________。
②要将纯碱高温熔化,下列坩埚中可选用的是______(填序号)。
a.普通玻璃坩埚 b.石英玻璃坩埚 c.氧化铝坩埚 d.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com