
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1mol氢气的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体所含分子数相同 | |
| D. | 标准状况下,1mol任何物质的体积都约为22.4L |
分析 A.摩尔是物质的量的单位;
B.氢气摩尔质量为2g/mol,质量m=nM计算分析;
C.在同温同压下,相同体积的任何气体中含有的分子数相同;
D.依据气体摩尔体积的概念和应用条件分析判断,气体摩尔体积是对气体计算.
解答 解:A.摩尔是物质的量的单位,不是物理量,故A错误;
B.氢气摩尔质量为2g/mol,1mol氢气的质量=1mol×2g/mol=2g,故B错误;
C.依据阿伏伽德罗定律可知,在同温同压下,相同体积的任何气体中含有的分子数相同,故C正确;
D.标准状况下,1mol任何气体的体积都约为22.4L,固体和纯液体不符合,故D错误;
故选C.
点评 本题考查物质的量、摩尔质量、气体摩尔体积的定义、单位等,题目难度不大,注意相关概念的积累.


科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口下沿处 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 能用CCl4从碘水中萃取碘是由于CCl4与H2O互不相溶且碘在CCl4中溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe 与S混合加热生成FeS | |
| B. | Fe与Cl2反应生成FeCl2 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | 氯气具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)称取M 4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)M的摩尔质量为:90g/mol. |
| (2)将此4.5g M在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | (2)M的分子式为:C3H6O3. |
| (3)通过M的红外光谱图发现该分子中既有羟基,还有羧基(--COOH) | (3)写出M中含有官能团羟基的电子式: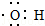 |
(4)M的核磁共振氢谱如图: | (4)M中含有4种氢原子. |
(5)综上所述,M的结构简式为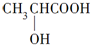 . . | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
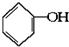 合成
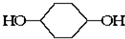
合成 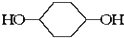 .(部分试剂和反应条件已略去)已知D为1,3-环己二稀
.(部分试剂和反应条件已略去)已知D为1,3-环己二稀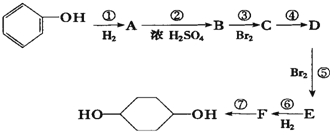

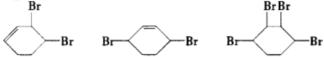 .
. 的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3
的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3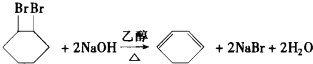 (有机物写结构简式,并注明反应条件)
(有机物写结构简式,并注明反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
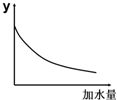
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
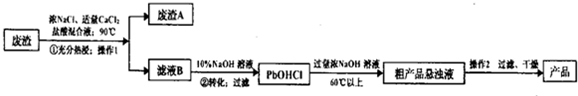
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 略小于20% | B. | 略大于20% | C. | 20% | D. | 80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com