
【题目】既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是( )
①Al ②Al2O3 ③NaHCO3 ④Al(OH)3
A. ③④B. ②③④C. ①③④D. 全部
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣、HCO3﹣等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示: 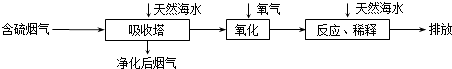 下列说法错误的是( )
下列说法错误的是( )
A.天然海水pH≈8的原因是由于海水中的CO32﹣、HCO3﹣水解
B.“氧化”是利用氧气将H2SO3、HSO3﹣、SO32﹣等氧化生成SO42﹣
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42﹣的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率加快的是( )
A. 改用98%的浓硫酸B. 增加锌粒的量C. 用锌块代替锌粒D. 加入少许硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.Cu2O在稀硫酸中生成Cu和CuSO4 .
(1)基态Cu原子核外有个不同运动状态的原子.Cu+基态核外电子排布式为
(2)醛基中碳原子的轨道杂化类型是;1mol乙醛分子中含有σ的键的数目为 . 乙醛可被氧化为乙酸.乙酸的沸点明显高于乙醛,其主要原因是: .
(3)氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.
(4)铜晶胞为面心立方晶体,其晶胞参数a=361.49pm,晶胞中铜原子的配位数为 . 列式表示铜单质的密度gcm﹣3 (不必计算出结果).将Cu单质的粉末加入NH3的浓溶液中,通入O2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素). 
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2﹣的离子方程式 .
(2)含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示. 
①下列说法正确的是(填标号).
A.pH=7时,溶液中c(Na+)<c(HSO3﹣)+c(SO32﹣)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10﹣7
C.为获得尽可能纯的NaHSO3 , 应将溶液的pH控制在4~5为宜
D.pH=9时的溶液中c(OH﹣)=c(H+)+c(HSO4﹣)+c(H2SO4)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2 , 则反应的离子方程式为 .
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 .
(3)装置Ⅲ的作用之一是再生Ce4+ , 其原理如图2所示. 图中A为电源的(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为 .
(4)已知进人装置Ⅳ的溶液中NO2﹣的浓度为0.4mol/L,要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 需至少向装置Ⅳ中通入标准状况下的O2的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 碱金属与氧气化合生成的产物都属于碱性氧化物
B. K与水反应比Na与水反应更剧烈
C. 碱金属锂、钠、钾都可以保存在煤油中
D. 碱金属单质具有强还原性,形成的离子具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式为  ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )
A.先加酸性高锰酸钾溶液,后加银氨溶液,微热
B.先加溴水,后加酸性高锰酸钾溶液
C.先加新制氢氧化铜,微热,再加入溴水
D.先加入银氨溶液,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质发生转化所克服的粒子间的相互作用属于同种类型的是( )
A. 碘和干冰升华B. 氯化钠的熔化与冰的融化
C. 氯化氢和酒精溶于水D. CO2气体通入澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去): 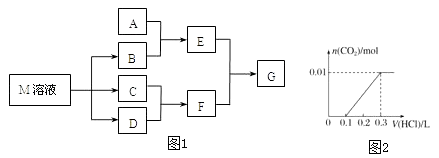
(1)写出用惰性电极电解M溶液的离子方程式 . 写出F的电子式
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 .
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示:则A与B溶液反应后溶液中的溶质化学式为 .
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 .
(6)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com