
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心e处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体上滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O)
(1)e处反应的离子方程式为_____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为________________,d处的实验现象为___________________。
(3)c处反应的化学方程式为_______________________ ______,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。(若不能,此空不填)
(1)2MnO4– + 16H+ + 10Cl– = 2Mn2+ +5Cl2↑+ 8H2O 1:5 (每空2分)
(2)溶液由无色变为蓝色 溶液变为血红色 (每空1分)
(3)Cl2 + 2NaOH =" NaCl" + NaClO + H2O 0.01 (每空2分)
(4)能 (1分) KMnO4>Cl2>FeCl3 (2分)
解析试题分析:(1) e处发生反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,改写成离子方程式则为:2MnO4– + 16H+ + 10Cl– = 2Mn2+ +5Cl2↑+ 8H2O,从方程可知,KMnO4为氧化剂,其物质的量为2mol,HCl为还原剂,其物质的量为10mol,故两者物质的量之比为1:5。
(2)b处发生的反应为:Cl2 + 2KI =" 2KCl" + I2,生成的I2遇淀粉变蓝色;d处反应为:Cl2 + 2Fe2+ = 2Fe3+ + 2Cl–,Fe3+ + 3SCN– = Fe(SCN)3,所以溶液显血红色。
(3)c处Cl2与NaOH溶液反应:Cl2 + 2NaOH =" NaCl" + NaClO + H2O,标准状况下,0.224L Cl2的物质的量为0.01mol,因每1mol Cl2反应,转移1mol电子,所以转移的电子的物质的量为0.01mol。
(4)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂为KMnO4,氧化产物为Cl2,反应Cl2 + 2FeCl2 = 2FeCl3中,氧化剂为Cl2,氧化产物为FeCl3,根据“氧化剂的氧化性比氧化产物强”的规律可推知氧化性强弱顺序为:KMnO4>Cl2>FeCl3。
考点:考查氯气的制备和性质、氧化还原反应的相关内容。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:填空题
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银。步骤如下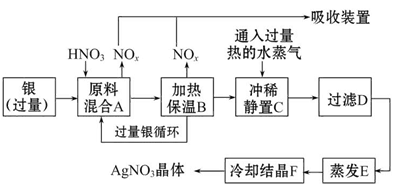
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用________硝酸(填“浓”或“稀”)。原因是________ (填序号,下同)
a.减少过程中产生NOx的量
b.减少原料银的消耗量
c.节省硝酸的物质的量
(2)步骤B加热保温的作用是________。
a.有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是________。
a.置换反应
b.水解反应
c.氧化还原反应
产生的沉淀物化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
(1)氨气催化氧化的化学方程式为 _
(2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O 若处理1×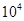 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。
(3)NO和CO都是汽车尾气中的有害物质,必须进行处理。为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出净化过程中的总化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+ 和 。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | | FeS2 | S | Na2S2O3 | | SO3或H2SO4或Na2SO4 | Na2S2O8 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
(1)石灰氮的化学式为 。
(2)足量B和C与饱和氯化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式 。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为 (填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用是 (填序号)。
a、磷酸 b、二氧化碳 c、稀硫酸 d、二氧化硫 e、次氯酸
(4)工业废水中的NO2— 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是 ;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com