
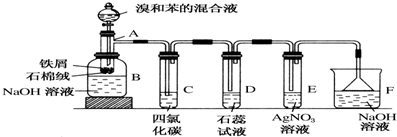
 .
.分析 探究苯和液溴的反应,苯和液溴在铁粉作催化剂的作用下生成溴苯和溴化氢,生成的溴苯不溶于水且密度比水大,为红褪色;可利用NaOH溶液除去混在溴苯中的液溴,此反应为放热反应,生成的HBr混有苯和溴,利用四氯化碳除去HBr中混有的杂质,利用石蕊试液检验HBr气体的水溶液显酸性,利用硝酸银检查Br-的存在,利用NaOH只收尾气,因HBr极易溶解于水,反应容器上方会出现白雾,尾气处理时需要防倒吸,据此分析解题;
(1)苯与液溴在催化剂作用下发生取代反应;
(2)溴易挥发,易溶于有机溶剂,溴化氢溶于水电离产生氢离子和氯离子;
(3)溴化铁与氢氧化钠反应生成氢氧化铁沉淀,溴苯密度大于水,是无水油状液体,溴化氢易挥发;
(4)根据防倒吸的原理解答.
解答 解:探究苯和液溴的反应,苯和液溴在铁粉作催化剂的作用下生成溴苯和溴化氢,生成的溴苯不溶于水且密度比水大,为红褪色;可利用NaOH溶液除去混在溴苯中的液溴,此反应为放热反应,生成的HBr混有苯和溴,利用四氯化碳除去HBr中混有的杂质,利用石蕊试液检验HBr气体的水溶液显酸性,利用硝酸银检查Br-的存在,利用NaOH只收尾气,因HBr极易溶解于水,反应容器上方会出现白雾,尾气处理时需要防倒吸,据此分析解题;
(1)苯与液溴在铁催化下反应生成溴苯和溴化氢,反应的化学方程式为: ;
;
故答案为: ;
;
(2)溴易挥发,易溶于有机溶剂,所以用C来吸收吸收溴化氢中的溴和挥发的有机物蒸汽,防止对溴化氢的检验造成干扰;溴化氢溶于水电离产生氢离子和氯离子,所以溶液显酸性,能使石蕊变红色,硝酸银中的银离子与溴离子反应生成淡黄色的沉淀,反应的离子方程式为:Ag++Br-=AgBr↓;
故答案为:吸收溴化氢中的溴和挥发的有机物蒸汽;Ag++Br-=AgBr↓;D中石蕊变红色、E中产生淡黄色的沉淀;
(3)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,溴化铁与氢氧化钠反应生成红褐色的氢氧化铁沉淀,
故答案为:溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾;
(4)装置D和E导管口在液面上方,能防止倒吸,倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,
故答案为:DEF.
点评 本题为实验题,考查了溴苯的制取,明确苯的结构和性质是解题关键,注意不同的防止倒吸装置的原理.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变为原来的10-3倍 | B. | 变为 原来的10-2倍 | ||
| C. | 变为原来的103倍 | D. | 不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
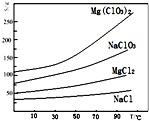 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
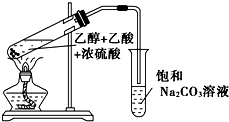 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
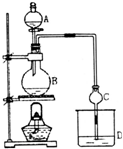 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通常用小黑点来表示电子的多少 | |
| B. | 小黑点密表示在该核外空间的电子数多 | |
| C. | 小黑点密表示在该核外空间的单位体积内电子出现的概率大 | |
| D. | 通常用小黑点来表示电子绕核作高速圆周运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
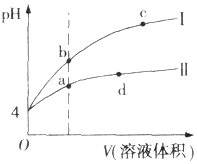 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com