
【题目】有关下列四组实验描述不正确的是
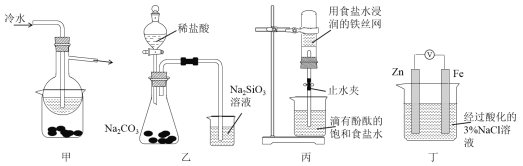
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
【答案】B
【解析】
A.SiO2受热不分解,而NH4Cl受热分解;B.盐酸有挥发性,生成的CO2中混有HCl,另外氯元素的最高价氧化物对应水化物为HClO4;C.该装置构成原电池,该装置中铁发生吸氧腐蚀;D.Zn-Fe原电池中Zn为负极,Fe为正极。
A.SiO2受热不分解,而NH4Cl受热分解,利用加热甲装置中的烧杯可以分离SiO2和NH4Cl,故A正确;B.氯元素的最高价氧化物对应水化物为HClO4,另外盐酸有挥发性,生成的CO2中混有HCl,无法判断碳酸的酸性比硅酸强,由装置乙无法证明非金属性强弱:Cl>C>Si,故B错误; C.该装置构成原电池,该装置中铁发生吸氧腐蚀,一段时间内试管内压强减小,烧杯内溶液上升到试管中,故C正确;D.Zn-Fe原电池中Zn为负极,Fe为正极,烧杯内无Fe2+,则滴入2滴铁氰化钾溶液,烧杯中不会有蓝色沉淀生成,故D正确;故答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是
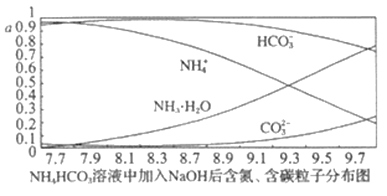
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用阴离子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将V1mL0.50mol/LH2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下图所示(实验中始终保持V1 +V2=50mL)。回答下列问题:

(1)上图所示实验装置中有一个明显的错误________________。
(2)为了减少实验误差,实验过程中将NaOH溶液________________ (选填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3)研究小组做该实验时环境温度________ 22°C(填“高于”、“ 低于”或“等于”),判断的依据是___________________。
(4)由题干及图形可知,V1:V2=_________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________ mol/L。
(5)若通过实验测定及有关计算知此反应共放出a kJ的热量.请写出此反应的热化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如表。则此时正、逆反应速率的关系是____。
CH4 | H2O | CO | H2 |
3.0molL-1 | 8.5molL-1 | 2.0molL-1 | 2.0molL-1 |
(2)为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=____,P=_____;设计实验2、3的目的是________________;
实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
(3)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率υ(H2)=_______,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于影响化学反应速率的条件的说法正确的是( )
A.增大压强一定能加快化学反应速率
B.使用催化剂对化学反应速率没影响
C.增加反应物的量一定能加速化学反应速率
D.升高温度,一般能加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略):
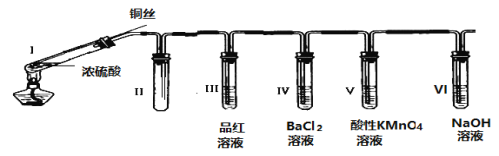
请回答:
(1)连接好装置后,接下来的操作步骤是________________
(2)浓硫酸与铜丝反应的化学方程式为________________
(3)装置II的作用是________________
(4)下列说法正确的是________________
A 反应一段时间后,向试管Ⅰ中的溶液加水,溶液呈蓝色
B 试管III、V中溶液都会褪色,其褪色原理相同
C 取下试管IV并不断振荡,试管中出现浑浊,是因为生成了BaSO4
D 试管VI中NaOH溶液用于吸收尾气,可用Na2CO3溶液代替
(5)某同学根据所学化学知识认为:反应完毕时,不管铜是否过量,硫酸一定有剩余。下列药品能证明反应结束时I试管中确有余酸的是________________
A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为__________________。
(2)ZX3分子的空间构型为__________________, ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是_____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为:______________________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。
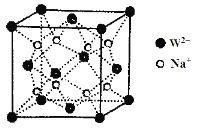
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Cu投入到100mL18mol·L﹣1的浓硫酸中,加热使之充分反应,在标准状况下收集到4.48L气体(假设气体全部逸出)。请计算:
(1)收集到气体的物质的量为__mol。
(2)若往反应后的溶液中加入NaOH溶液,并使得溶液中的Cu2+完全沉淀,至少需要8mol·L﹣1NaOH_____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com