
常温下,pH=1的某溶液A中还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示:
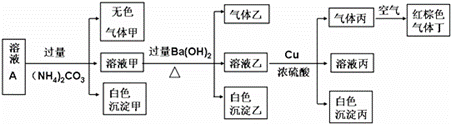
下列有关说法正确的是( )
A.沉淀乙一定有BaCO3,可能有BaSO4
B.实验消耗Cu 14.4 g,则生成气体丙为3.36L
C.该溶液A中一定有NO3-、Al3+、SO42-、Cl-
D.生成的甲、乙、丙气体均为无色的易溶于水气体
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
一般情况下,前者无法决定后者的是 ( )
A.原子核外电子排布——元素在周期表中的位置
B.弱电解质的相对强弱——电离常数的大小
C.分子间作用力的大小——分子稳定性的高低
D.物质内部储存的能量高低——化学反应的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知14.2g X气体在标准状况下的体积是4.48L,则X气体的摩尔质量是 ( )
A.71g B.71 C.71g /mol D.142g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
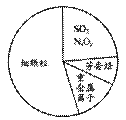
右图为雾霾的主要成分示意图。下列说法不正确的是( )
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.向空气中大量排放SO2和NxOy都能引起酸雨和光化学烟雾
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
查看答案和解析>>
科目:高中化学 来源: 题型:
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别( )
A. 2 mol、3 mol、6 mol
B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol
D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH
随加水量的变化。下列说法正确的是( )
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度
的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中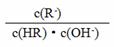 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1) NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是
和 。(填化学式)
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕色沉淀,向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为 。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
②现需要200mL 0.1mol/L的A溶液,需用托盘天平称取A固体的质量为 g,配制溶液时,所需要的玻璃仪器除玻璃棒、烧杯外,还需要 。
③利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,没有颜色变化的是( )
|
| A. | 淀粉溶液中加入稀硫酸 |
|
| B. | 鸡蛋清中加入浓硝酸 |
|
| C. | 淀粉溶液中加入碘酒 |
|
| D. | 葡萄糖溶液与新制氢氧化铜浊液混合加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com