
| X | Y | Z | |
| W |
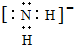 ,
,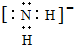 ;
;| 催化剂 |
| △ |
| 催化剂 |
| △ |
| ||
| ||


科目:高中化学 来源: 题型:
 砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.查看答案和解析>>
科目:高中化学 来源: 题型:
 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
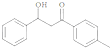 的同分异构体有许多.能与NaHCO3反应,且含有联苯基(
的同分异构体有许多.能与NaHCO3反应,且含有联苯基( 上1个氢原子被取代)的同分异构体共有
上1个氢原子被取代)的同分异构体共有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 组成和结构信息 |
| a | 由两种元素组成含有A的离子化合物 |
| b | 由两种元素组成含有非极性共价键的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com