
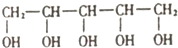
 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )| A. | 木糖醇易溶于水,溶解过程的△H>0 | |
| B. | 一定条件下,木糖醇能与HCl反应,也能与醋酸反应,属于同一反应类型 | |
| C. | 木糖醇是一种单糖,不能发生水解反应 | |
| D. | 1mol木糖醇与足量的钠反应最多可产生2.5molH2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 光催化还原水制氢气比电解水制取氢更节能环保、更经济 | |
| B. | 氯气加压液化可用钢瓶贮存运输 | |
| C. | 向汽油中添加甲醇后,可减少汽车尾气的排放 | |
| D. | 明矾既可做净水剂也可作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol-CH3含有的电子数为10NA | |
| B. | 92gNO2气体中含有原子数为6NA | |
| C. | 1molC2H4分子中含共价单键总数为8NA | |
| D. | 标准状况下22.4LCHCl3中含有原子总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- | |
| B. | 漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| C. | 向NH4Al(SO4)2溶液中逐渐滴入加入Ba(OH)2溶液恰好使SO42-反应完全: 2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| D. | FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
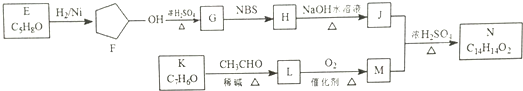
 .
. .
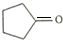
.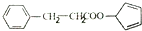 ,请再写出三种五元环上不是含一个双键的同分异构体:
,请再写出三种五元环上不是含一个双键的同分异构体: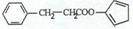 、
、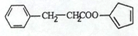 、
、 .
.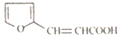 )是一种医治血吸虫病的药呋喃丙胺的原料.请以
)是一种医治血吸虫病的药呋喃丙胺的原料.请以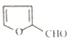 、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)
、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)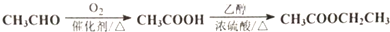
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
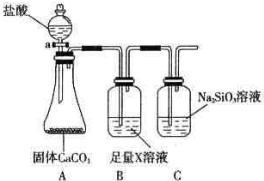
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
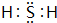 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com