


科目:高中化学 来源: 题型:
| A、用铂丝蘸取某盐溶液进行焰色反应,火焰呈黄色,说明该盐溶液含钠元素,一定不含钾元素 |
| B、配制100 mL 1 mol/L NaCl溶液,定容时俯视刻度线,则所配溶液浓度偏小 |
| C、只用胶头滴管和试管,不用其他试剂无法区别稀盐酸和K2CO3稀溶液 |
| D、纳米材料微粒直径一般从几纳米到几十纳米,将纳米材料分散到溶剂中得到的分散系,用可见光束照射具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
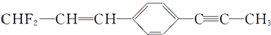 分子结构的下列叙述中,正确的是( )
分子结构的下列叙述中,正确的是( )| A、除苯环外的其余碳原子有可能都在一条直线上 |
| B、所有的原子都在同一平面上 |
| C、12个碳原子不可能都在同一平面上 |
| D、12个碳原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、25℃时,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2B的电离方程式为:H2B?2H++B2- |
| B、结合质子能力由强到弱的顺序为:B2->A->HB- |
| C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 |
| D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
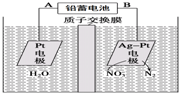
| A、铅蓄电池的A极为正极,电极材料为PbO2 |
| B、铅蓄电池工作过程中负极质量增加 |
| C、该电解池的阴极反应为:2NO3-+6H2O+10e-=N2↑+12OH- |
| D、若电解过程中转移2moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为10.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.5mol/L KClO3溶液 |
| B、200mL 2.5mol/L MgCl2溶液 |
| C、300mL 2mol/L AlCl3溶液 |
| D、400mL1mol/L 盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com