
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
【答案】B
【解析】
①铁在潮湿的空气中生锈是因为发生了电化学腐蚀,与平衡移动无关;②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深,是因为二氧化氮浓度的增加,并不是因平衡移动导致;③氯气溶于水存在平衡:Cl2+H2O![]() H++Cl-+HClO,而饱和食盐水中氯离子浓度达到饱和,氯离子浓度增大,平衡逆向移动,故不能再溶解氯气,因此实验室可用排饱和食盐水的方法收集氯气,能用勒夏特列原理解释;④钠与氯化钾共融制备Na(l)+KCl(l)
H++Cl-+HClO,而饱和食盐水中氯离子浓度达到饱和,氯离子浓度增大,平衡逆向移动,故不能再溶解氯气,因此实验室可用排饱和食盐水的方法收集氯气,能用勒夏特列原理解释;④钠与氯化钾共融制备Na(l)+KCl(l)![]() K(g)+NaCl(l) ,因反应条件为高温,生成物中K(g)挥发,使生成物浓度降低,平衡右移,能用勒夏特列原理解释;⑤啤酒中因有二氧化碳和水反应生成的碳酸,开启啤酒瓶后,压强降低,碳酸分解为二氧化碳和水,二氧化碳放出,瓶中马上泛起大量泡沫,能用勒夏特列原理解释;故答案为:①②,选B。
K(g)+NaCl(l) ,因反应条件为高温,生成物中K(g)挥发,使生成物浓度降低,平衡右移,能用勒夏特列原理解释;⑤啤酒中因有二氧化碳和水反应生成的碳酸,开启啤酒瓶后,压强降低,碳酸分解为二氧化碳和水,二氧化碳放出,瓶中马上泛起大量泡沫,能用勒夏特列原理解释;故答案为:①②,选B。


科目:高中化学 来源: 题型:
【题目】一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:

下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验。请回答:
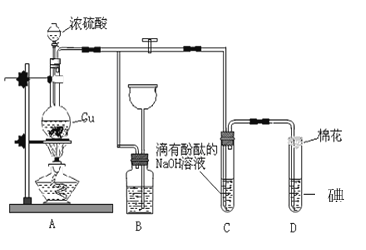
(1)装置A中发生的化学反应的化学方程式: _________________________________。
(2)装置B 的作用是__________________,B中广口瓶内应盛放的液体是_________(填序号)
①水 ②澄清石灰水
③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。C中反应的方程式:_______________________________________,而D 中则是由于SO2 具有_______性,D中反应的方程式:________________________。
(4)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余。 可以证明有余酸的实验方案是___________
A.可再加入锌粒 B.可再加入氯化钡溶液
C.再加入银粉 D.再滴入碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的化工原料,用煤作燃料不仅浪费,而且因烟煤中含有硫的化合物(FeS2)燃烧时生成SO2气体造成环境污染。假设一个具有3万户人口的小型城市,平均每户燃煤5kg,这种煤含FeS25%,在燃烧时如有90%的S转化为SO2,并被排入大气中,试计算:
(1)该城市仅居民作燃料用煤一年(365天)向大气中排放SO2的总质量达多少吨?______
(2)假如这些SO2全部能回收,可生产98%的H2SO4多少吨?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在生产、生命活动中有重要的作用。回答下列问题:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,写出在298K时,氨气燃烧生成N2的热化学方程式___________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=___________。
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=___________(用含有k正、k逆的式子表示)。
(3)构成肌红蛋白的甘氨酸(NH2CH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下:
![]()
![]()
![]()
![]()
![]()
在甘氨酸溶液中加入酸或碱,三种离子的百分含量与![]() 的关系如图所示:
的关系如图所示:

①纯甘氨酸溶液呈___________性;当溶液呈中性时三种离子的浓度由大到小的顺序为___________。
②向![]() =8的溶液中加入过量HCl时,反应的离子方程式为___________。
=8的溶液中加入过量HCl时,反应的离子方程式为___________。
③用电位滴定法可测定某甘氨酸样品的纯度.

称取样品150mg,在一定条件下,用0.1000mol/L的高氯酸溶液滴定(与甘氨酸1︰1发生反应),测得电压变化与滴入HClO4溶液的体积关系如下图。做空白对照实验,消耗HClO4溶液的体积为0.25mL,该样品的纯度为___________%(计算结果保留一位小数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的反应是

A. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
B. 2SO2(g)+O2(g)![]() 2SO3(g)ΔH< 0
2SO3(g)ΔH< 0
C. H2(g)+I2(g)![]() 2HI(g)ΔH>0
2HI(g)ΔH>0
D. C(s)+H2O(g)![]() CO(g)+H2(g)ΔH>0
CO(g)+H2(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中,所发生的反应方程式为______________________________________。与电源_______极相连的电极附近溶液滴入酚酞显红色。阳极产物是______________,实验室用__________________________检验该物质。
(2)如果粗盐中SO42含量较高,必须添加钡试剂除去SO42,该试剂可以是_____________________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 d.BaCO3
(3)为有效除去Ca2+、Mg2+、SO42,加入试剂的合理顺序为__________________。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com