
【题目】某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是:①分子具有7个碳原子的芳香烃②分子中具有4个碳原子的烷烃③分子中具有12个氢原子的烷烃④分子中具有8个碳原子的烷烃( )
A.①② B.②③ C.③④ D.②④
科目:高中化学 来源: 题型:
【题目】E是一种治疗心血管疾病的药物,它的合成路线如下:
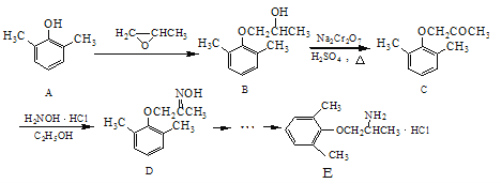
(1)C分子中含氧官能团的名称为_________________。
(2)由B→C的反应类型为_____________。
(3)由A制备B的过程中有少量副产物F,它与B互为同分异构体,E的结构简式为___________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:___________。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(5)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚 (
)。写出以邻甲基苯酚 ( 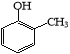 )和乙醇为原料制备
)和乙醇为原料制备 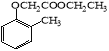 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
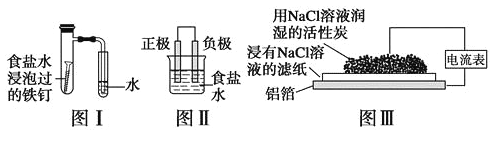
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组数字中,代表有机物的4种同系物的式量的( )
A.16.32.48.64
B.16.17.18.19
C.16.30.44.58
D.16.28.40.52
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的下列反应与其官能团无直接关系的是( )
A.乙醇与活泼金属反应
B.乙醇和氧气在Cu的催化下反应
C.乙醇被酸性高锰酸钾氧化
D.乙醇在空气中点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
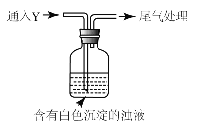
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
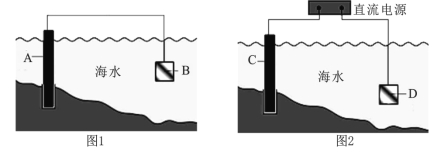
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
该电化学保护方法的名称是 。
(2)图2中,钢闸门C为 极,用氯化钠溶液模拟海水进行实验,D为石墨块,总反应的离子方程式为 。
(3)有关上述实验,下列说法正确的是 。
A.溶液中Na+向D极移动
B.从D极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)模拟工业上离子交换膜法制烧碱的方法,可用如图装置电解硫酸钾溶液来制取H2、O2、H2SO4和KOH。
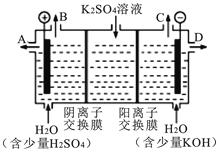
①该电解槽的阳极反应方程式为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”) 导出。
③若采用CH4燃料电池(石墨为电极,KOH为电解质溶液)为电源,则该电池的负极电极方程式为 ,若B极产生标准状况下22.4 L气体,则理论上需要通入 mol CH4。
④电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
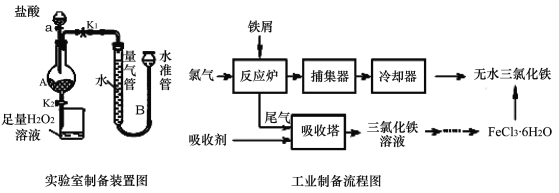
已知:(1)无水FeCl3熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入 后、 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c molL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。样品中氯化铁的质量分数 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com