
下列推断正确的是( )
A.共价键只有方向性
B.离子晶体中只存在阴阳离子间的静电吸引力
C.Na2O2中阴阳离子个数比为1:2
D.化学式CO2、SiO2、NaCl、CaH2都可以表示分子
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【定量实验设计】某研究性学习小组查阅资料获得晶体M的制备原理,他们进行如下探究:
【制备晶体】
以CrCl2•4H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了晶体M。
(1)溶液中分离出晶体M的操作包括蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
他们用冰水和饱和食盐水的混合物洗涤晶体M,其目的是 。
制备过程中需要加热,但是,温度过高造成的后果是 。
【测定组成】
为了测定M晶体组成,他们设计如下实验。装置如图所示(加热仪器和固定仪器省略)。
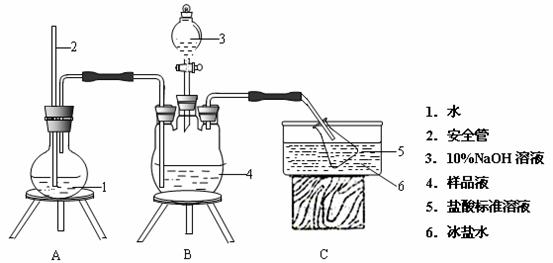
为确定其组成,进行如下实验:
①氨的测定:精确称M晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量20% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用一定量的盐酸溶液吸收。蒸氨结束后取下接收瓶,用一定浓度的NaOH标准溶液滴定过剩的HCl,到终点时消耗一定体积的 NaOH溶液。
②氯的测定:准确称取a g样品M溶于蒸馏水,配成100 mL溶液。量取25.00 mL配制的溶液用c mol·L1AgNO3标准溶液滴定,滴加3滴0.01 mol·L1K2CrO4溶液(作指示剂),至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色),消耗AgNO3溶液为b mL。
(2)安全管的作用是 。
(3)用氢氧化钠标准溶液滴定过量的氯化氢,部分操作步骤是检查滴定管是否漏液、用蒸馏水洗涤、 、排滴定管尖嘴的气泡、 、滴定、读数、记录并处理数据;下列操作或情况会使测定样品中NH3的质量分数偏高的是 (填代号)。
A.装置气密性不好 B.用酚酞作指示剂
C.滴定终点时俯视读数 D.滴定时NaOH溶液外溅
(4)已知:硝酸银热稳定性差;Ksp(Ag2CrO4)=1.12×1012,Ksp(AgCl)=1.8×1010
选择棕色滴定管盛装标准浓度的硝酸银溶液,滴定终点时,若溶液中
c(CrO42)为2.8×103 mol·L1,则c(Ag+)= 。
(5)根据上述实验数据,列出样品M中氯元素质量分数计算式 。
如果滴加K2CrO4溶液过多,测得结果会 (填:偏高、偏低或无影响)。
(6)经测定,晶体M中铬、氨和氯的质量之比为104∶136∶213。写出制备M晶体的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不符合ⅦA族元素性质特征的是
A.易形成-1价离子 B.从上到下原子半径逐渐减小
C.从上到下非金属性逐渐减弱 D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,乙物质的化学式是 •
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.一般σ键比π键电子云重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,两个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.C、N、O三种元素第一电离能从大到小的顺序是 O>N>C
B.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
C.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
D. Ni原子的核外电子排布式为1s22s22p63s23p63d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.原子半径 Na>Si>Cl
B.金属性 Na>Mg>Al
C.稳定性 SiH4<HCl<H2S
D.酸性 H3PO4<H2SO4<HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com