
分析 (1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,标出电子的转移方向和数目;
(2)根据n=$\frac{m}{M}$计算KMnO4的物质的量,根据方程式计算生成氯气物质的量,被氧化的HCl生成氯气,根据氯原子是计算被氧化HCl物质的量;
(3)根据V=nVm计算生成氯气的体积;
(4)根据化学方程式结合电子转移知识来计算.
解答 解:(1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,用双线桥表示电子转移的方向和数目为 ,
,
答:双线桥法标出反应中电子得失数目为 ;
;
(2)15.8g KMnO4的物质的量为$\frac{15.8g}{158g/mol}$=0.1mol,根据2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,可知n(Cl2)=2.5n(KMnO4)=0.1mol×2.5=0.25mol,被氧化的HCl生成氯气,根据氯原子可知,被氧化HCl物质的量为0.25mol×2=0.5mol,
答:被氧化的HCl为0.5mol;
(3)标况下生成氯气的体积为0.25mol×22.4L/mol=5.6L,答:Cl2在标准状况下的体积为5.6L;
(4)根据 得到:消耗2mol高锰酸钾转移10mol电子,所以消耗0.1mol高锰酸钾,转移电子的物质的量是0.5mol,数目是3.01×1023,答:转移电子的数目是3.01×1023.
得到:消耗2mol高锰酸钾转移10mol电子,所以消耗0.1mol高锰酸钾,转移电子的物质的量是0.5mol,数目是3.01×1023,答:转移电子的数目是3.01×1023.
点评 本题考查化学方程式的有关计算,题目难度不大,本题注意有关计算公式的利用,以及电子转移的方向和数目的双线桥标出法.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的溶沸点依次升高 | |
| B. | 在气态单质分子中,一定存在共价键 | |
| C. | 只含离子键的化合物才是离子化合物 | |
| D. | 在共价化合物中,一定存在着共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+H2(g)═C(s)+H2O(g)△H=-131.28 kJ•mol-1 | |
| B. | C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94 kJ•mol-1 | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)△H=-131.28 kJ•mol-1 | |
| D. | C(s)+H2O(l)═CO(g)+H2(g)△H=+131.28 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol•L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制氢气时,改用铁片和浓硫酸反应可增大反应物浓度,所以可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应活化能降低,反应速率加快 | |
| D. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 需区分的物质 | 实验方法 |
| A | 白酒和白醋 | ①观察颜色②闻气味 |
| B | 食盐和白糖 | ①加稀盐酸②加水溶解 |
| C | 合成纤维和天然纤维 | ①点燃闻气味②观察色泽 |
| D | 酸性厕所清洁剂与碱性厨房清洁剂 | ①测pH②加石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y、Z的简单离子具有相同的电子层结构 | |
| B. | W的简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Z两种元素组成的化合物中阴阳离子个数比一定为1:2 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.03×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 向100mL 1mol/L FeBr2溶液中通入0.5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
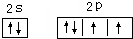 ;
;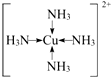 (用元素符号表示).
(用元素符号表示).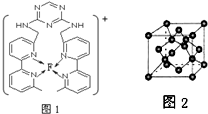
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com