
 一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )| A. | 如用此种电池电镀铜,待镀铜金属上增重19.2g,则至少消耗标准状况下2.24L CH4 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
分析 甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-,以此解答该题.
解答 解:A.反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,所以待镀铜金属上增重19.2g即$\frac{19.2}{64}$=0.3mol,则转移0.6mol电子,所以至少消耗标准状况下0.1×22.4=2.24L CH4,故A正确;
B.电解质没有OH-,负极反应为H2+CO+2CO32--4e-=H2O+3CO2,故B错误;
C.电池工作时,CO32-向负极移动,即向电极A移动,故C错误;
D.B为正极,正极为氧气得电子生成CO32-,电极反应为:O2+2CO2+4e-=2CO32-,故D正确.
故选AD.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池工作时,电子由正极通过外电路流向负极 | |
| C. | 电池正极的电极反应式为:MnO2(s)+2H2O(1)+2e-═Mn(OH)2 (s)+2OH-(aq) | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO3溶液中加入NaHSO4溶液:HSO${\;}_{3}^{-}$+H+═H2O+SO2↑ | |
| B. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
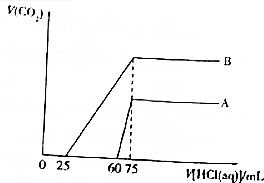 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com