


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学--物质结构与性质】
【化学--物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
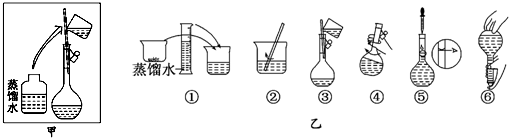
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解 |
| B、与氯气反应时,铝失去3个电子,而铜失去2个电子 |
| C、常温下,铝在浓硝酸中钝化而铜不发生钝化 |
| D、常温下将铝和铜用导线连接放入到稀盐酸中,铝为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分类方法应用广泛 |
| B、纳米级粒子的尺寸与胶体粒子尺寸大致相当 |
| C、胶体属于介稳体系 |
| D、Fe(OH)3胶体与CuSO4溶液必须用丁达尔效应区分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com