
有A、B、C、D同周期的四种元素,其原子序数依次增大,且质子数均小于18。A元素原子的最外层只有1个电子,该元素阳离子与N3-核外电子排布相同;B元素原子核外各轨道上均无成单电子;C元素原子的价电子排布为ns2np1;D-的核外电子构型与Ar相同。
(1)写出A、C、D的元素名称:A________,C________,D________。
(2)写出B元素原子的电子排布式__________________________________________。
D元素原子的电子排布图_________________________________________________。
(3)A、B、C、D电负性由小到大的顺序为(填元素符号)_____ ___。
科目:高中化学 来源: 题型:阅读理解
 (2011?丹东模拟)有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
(2011?丹东模拟)有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(1)写出化合物Y所含的化学键名称 ;
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示) ;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为 ;
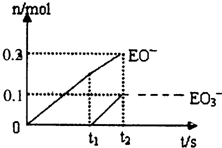
(5)一定量的石灰乳中通人一定量的E单质。两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则t2时刻消耗氢氧化钙质量为 g,此时反应的化学方程式为 。
(6)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠化合物。写出它与乙醇反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省孝感高中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表:
| 元素编号 | 相关信息 |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| C | 基态时, 2p 轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| F | 与E同周期,原子核外所有p轨道:有的全满有的半满 |
| G | 是第四周期元素中未成对电子数最多的元素 |
查看答案和解析>>
科目:高中化学 来源:2013届湖北省高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表:
|
元素编号 |
相关信息 |
|
A |
所处的周期数、族序数分别与其原子序数相等 |
|
B |
基态时,电子分布在三个能级上,且各能级中电子数相等 |
|
C |
基态时, 2p 轨道处于半充满状态 |
|
D |
与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
|
E |
原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
F |
与E同周期,原子核外所有p轨道:有的全满有的半满 |
|
G |
是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)A、B两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为 ,其中B原子采取 杂化。
(2)B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)。
(3)C的氢化物比F的氢化物的沸点__________(填“高”或“低”),C的氢化物比F的氢化物的稳定性__________(填“强”或“弱”)。
(4)A2D的VSEPR模型名称为__________;
写出与A2D分子互为等电子体的微粒__________(填一种)
(5)写出E3C2的电子式 ;
(6)G的基态原子核外电子排布式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com