
| A. | 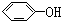 与 与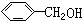 | B. | CH4与C3H8 | ||
| C. | 乙二醇和丙三醇 | D. | CH3CH=CHCH3 和CH2=C(CH3)2 |
分析 结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物.多用于有机化合物.
同系物判断规律:①一差:分子组成相差若干个CH2原子团,即相对分子质量差保持一致,犹如等差数列中的公差. ②一同:同通式.③一似:结构相似.
同系物的特点:1.同系物一定符合同一通式;但符合同一通式的不一定是同系物.2.同系物必为同一类物质.3.同系物化学式一定不相同.4.同系物的组成元素相同.5.同系物结构相似,不一定完全相同.6.同系物之间相差若干个CH2原子团.
解答 解:A、 属于酚类,而
属于酚类,而 属于醇类,两者结构不相似,不互为同系物,故A错误;
属于醇类,两者结构不相似,不互为同系物,故A错误;
B、CH4是甲烷,C3H8是丙烷,均为烷烃,分子式相差2个CH2,故互为同系物,故B正确;
C、乙二醇和丙三醇虽然均属于醇类,但乙二醇是二元醇,丙三醇是三元醇,两者相差的不是CH2,不是同系物,故C错误;
D、CH3CH=CHCH3 和CH2=C(CH3)2的分子式相同而结构不同,互为同分异构体,故D错误.
故选B.
点评 本题考查了同系物的概念,应注意概念的把握:结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 1.10×10-10m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| B. | 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
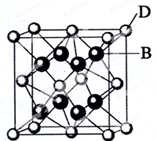 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
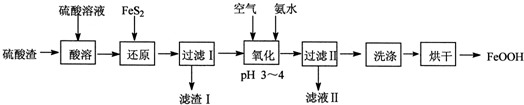
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com