



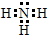

 .
. 分析 (1)质子数=原子序数,质子数+中子数=质量数,根据原子表示法来回答;
(2)元素周期表中8、9、10三个纵行为第ⅤⅢ族;
(3)同主族元素的原子,从上到下元素的非金属性逐渐减弱,同周期元素的原子,从左到右元素的非金属性逐渐增强;
(4)一至七周期元素的种类分别为2、8、8、18、18、32、26;
(5)离子化合物利用离子符合表示电子式,共价化合物利用共用电子对结合;
(6)镁原子最外层有两个电子易失去最外层的2个电子形成稳定的镁离子,卤原子最外层有7个电子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁;
硫化氢为共价化合物,根据共价化合物的电子式表示方法写出硫化氢的形成过程.
解答 解:(1)质子数=原子序数,质子数决定元素种类,所以含有8个质子的元素是O,并且质子数+中子数=质量数,所以该元素的质量数是18,表示为8180,故答案为:8180;
(2)周期表中位于第8纵列的铁元素属于ⅤⅢ族,故答案为:ⅤⅢ;
(3)根据元素周期律:同主族元素的原子,从上到下元素的非金属性逐渐减弱,同周期元素的原子,从左到右元素的非金属性逐渐增强,所以非金属性最强的是F,位于第17纵列,属于第ⅥⅠA族,故答案为:17;
(4)元素周期表中,在第6、7(或六、七)周期的第ⅢB族出现镧系和锕系元素,所含元素种数最多,故答案为:6;7;
(5)NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为 ,
,
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为 ;
;
NH3的电子式为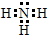 ;
;
故答案为: ;
; ;
; ;
;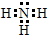 ;
;
(6)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为 ,
,
硫化氢为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为 ,
,
故答案为: ;
; .
.
点评 本题考查元素周期表的结构及应用、电子式及化合物形成过程等,为高频考点,把握元素在周期表的位置及电子式的概念及表示方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R 原子的最外层上有 4 个电子 | B. | RO3 n- 中的 R 只能被还原 | ||
| C. | R 的单质既有氧化性又具有还原性 | D. | HnRO3一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl+H2O═HCl+NaOH | B. | Cu+H2SO4═CuSO4+H2↑ | ||
| C. | 4HNO3═2H2O+4NO2↑+O2 | D. | 3Fe+4H20(g)═Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>Cl>P | B. | 热稳定性HCl>HBr>AsH3 | ||
| C. | 酸性:H3AsO4>H2SO4>H3PO4 | D. | 还原性:S2->Cl->Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com