
 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7  CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11 H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8 (2) ABC
(2) ABC  H++Cl-+HClO , K=
H++Cl-+HClO , K= 
 。
。 H++Cl-+HclO。所以平衡常数的表达式是
H++Cl-+HclO。所以平衡常数的表达式是 。如果加入氯化钠固体,则氯离子浓度增大,平衡向逆反应方向移动。压强越大,气体的溶解度越,但平衡常数只和温度有关系,所以平衡常数是不变的。根据平衡常数可知,碳酸的酸性强于次氯酸的,次氯酸的酸性强于碳酸氢钠的,所以根据较强的酸制取较弱的酸的原理可知,反应的方程式为Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-。
。如果加入氯化钠固体,则氯离子浓度增大,平衡向逆反应方向移动。压强越大,气体的溶解度越,但平衡常数只和温度有关系,所以平衡常数是不变的。根据平衡常数可知,碳酸的酸性强于次氯酸的,次氯酸的酸性强于碳酸氢钠的,所以根据较强的酸制取较弱的酸的原理可知,反应的方程式为Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-。

科目:高中化学 来源:不详 题型:单选题
| A.只有①②③④ | B.只有④⑤⑥ | C.只有①③⑤⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
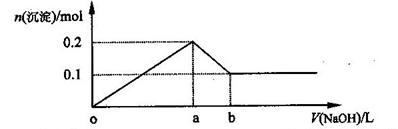
| A.NaOH的浓度为0.6 mol/L | B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 | D.图中线段oa : ab=5 : 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.③⑥ | C.②④⑥ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
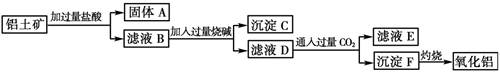
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
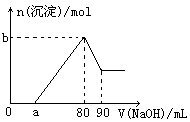
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com