
25℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④ C.③>②>①>④ D.④>①>②>③
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2016-2017学年河南省高一上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强
B.已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+
C.已知还原性B->C->D-,反应2C-+D2=2D-+C2和2C-+B2=2B-+C2都能发生
D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上期中化学卷(解析版) 题型:选择题
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是 ( )
A. 分子中的C、H、O的个数比为1:2:3 B. 该分子中肯定不含氧元素
C. 该有机物的相对分子质量为14 D. 分子中C、H个数比为1:2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>’’、“<’’或“ =’’)》
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
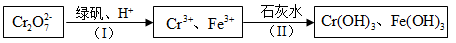
绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH) 3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:选择题
用标准盐酸溶液滴定待测浓度的碱溶液时,下列操作中会引起碱溶液浓度的测定值偏大的是( )
A.锥形瓶里溶液在滴定过程中溅出
B.锥形瓶用蒸馏水冲洗后未用待测液润洗
C.指示剂变色15 s后又恢复为原来的颜色便停止滴定
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:选择题
某化学科研小组研究在其他条件不变时,改变某一条件对反应A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
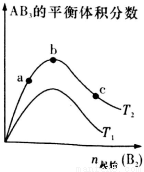
A.正反应一定是放热反应
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.b点时,平衡体系中A、B原子数之比接近3:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江中学高二上期中文化学卷(解析版) 题型:选择题
制造焊锡时,把铅加入锡的主要原因是( )
A.增加抗腐蚀能力 B.增加强度 C.降低熔点 D.增加延展性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江中学高二上期中文化学卷(解析版) 题型:选择题
分离汽油和氯化钠溶液的混合液体,应用下列哪种分离方法( )
A.蒸发 B.过滤 C.萃取 D.分液
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第三次月考化学试卷(解析版) 题型:选择题
下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是
A.氢氟酸 B.硫酸 C. 碳酸钠溶液 D.氧氧化钠溶液
碳酸钠溶液 D.氧氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com