
某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
5 Fe2+ +5C2O42—+3MnO4—+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42—)== ;
FeC2O4 的质量分数为 (精确到0.01%)
(1)重复以上实验1—2次(2分)
(2)用高锰酸钾标准溶液润洗滴定管(2分)
(3)KSCN(1分),溶液中没有出现血红色(1分)
(4)n(Fe2+)==0.001110mol(1分) n(C2O42—)==0.001010mol(1分)
FeC2O4 的质量分数为73.81%(2分)
(1)中和滴定实验为减少实验误差,一般要重复进行2-3次,取其平均值进行计算,这样可以减少误差,故步骤③也应该是再重复实验1-2次;(2)中和滴定操作的一般步骤是先检验活塞是否漏水,再洗涤,洗涤要先用蒸馏水洗,然后用待装的溶液润洗,以保证待装溶液的浓度不会被蒸馏水冲稀了,故这里要用待装的高锰酸钾标准溶液润洗滴定管;(3)加入锌粉和稀硫酸的目的是使铁离子还原成亚铁离子,所以是否合格的标准当然是看有无铁离子存在,没有铁离子存在即合格,否则就不合格,而检验铁离子的最好方法是加硫氰化钾,若溶液不变红,说明没有了铁离子,即合格;(4)设溶液中亚铁离子的物质的量为n1,草酸根离子的物质的量为n2,即有下列关系:
5Fe2+——————————MnO4—
5 1
n1 (42.40-31.30)mL×10—3L/mL×0.02000mol/L
n1=0.001110mol
5C2O42———————————2MnO4—
5 2
n2 (0.03130—0.01110)
n2=0.001010mol
w(FeC2O4)=0.001010mol×144g/mol÷0.1970g=73.81%


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 |
若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中,滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
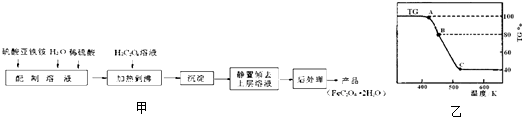
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
⑴配制(NH4)2Fe(SO4)26H2O溶液时,需加少量稀硫酸,目的是 。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江省牡丹江一中高三上学期期末考试化学试卷 题型:填空题
.(8分)草酸亚铁晶体(FeC2O4·2H2O)常用作分析试剂及显影剂等。下图是将一定质量的草酸亚铁在氩气氛围中进行热重分析的示意图(TG%表示残留固体质量占原样品质量的百分数)。请回答下列问题:
(1)B处残留物的化学式为 。C处残留物的化学式为 。
(2)A→C整个反应过程中总反应的化学方程式为 。
(3)上述FeC2O4·2H2O在氩气气氛中进行热重分析的原因是 。
若将分解得到的600℃时的固体与足量的浓硫酸反应后,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为 。
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s) + CO(g)  Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省茂名市第二次高考模拟考试理综化学试卷(解析版) 题型:实验题
草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L-1盐酸、3% H2O2、0.1 mol•L-1CuSO4、20% KSCN、蒸馏水。
|
实验步骤 |
现象与结论 |
|
步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 |
若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
|
步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
|
步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________
|
__________________________________ ___________________________________
|
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g 样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4 的质量分数为 (精确到0.01%,FeC2O4的式量为144)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com