
【题目】氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):

回答下列问题:
(1)A的结构简式是___________。
(2)C的化学名称是___________。
(3)②的反应类型是___________。
(4)E中不含N原子的官能团名称为___________。
(5)氨甲环酸(G)的分子式为___________。
(6)写出满足以下条件的所有E的同分异构体的结构简式:______________________。
a含苯环 b.与硝化甘油具有相同官能团 c.核磁共振氢谱有三组峰
(7)写出以![]() 和
和 为原料,制备医药中间体
为原料,制备医药中间体 的合成路线:_______________________________________________________(无机试剂任选)。
的合成路线:_______________________________________________________(无机试剂任选)。
【答案】CH2=CH-CH=CH2或![]() 2-氯-1,3-丁二烯 消去反应 碳碳双键、酯基 C8H15NO2
2-氯-1,3-丁二烯 消去反应 碳碳双键、酯基 C8H15NO2 

【解析】
由合成路线可知,A为1,3-丁二烯,1,3-丁二烯和氯气发生1,2-加成反应生成B; B发生消去反应生成C;对比C、D结构可知,由C生成D发生了双烯合成;D→E为-Cl被-CN取代,E→F为酯的水解反应, F→G为加氢的还原反应,以此分析解答。
由合成路线可知,A为1,3-丁二烯,1,3-丁二烯和氯气发生1,2-加成反应生成B; B发生消去反应生成C;对比C、D结构可知,由C生成D发生了双烯合成;D→E为-Cl被-CN取代,E→F为酯的水解反应, F→G为加氢的还原反应,
(1)由以上分析,A为1,3-丁二烯,结构简式是CH2=CH-CH=CH2;
故答案为:CH2=CH-CH=CH2;
(2)C的分子中含有两个碳碳双键,氯原子在第二个碳原子上,故化学名称是2-氯-1,3-丁二烯;
故答案为:2-氯-1,3-丁二烯;
(3)反应②为B发生消去反应生成C,故反应类型是消去反应;
故答案为:消去反应;
(4)E中含有-CN、碳碳双键和酯基,其中不含N原子的官能团名称为碳碳双键、酯基;
故答案为:碳碳双键、酯基;
(5)由结构简式可知,氨甲环酸(G)的分子式为C8H15NO2;
故答案为:C8H15NO2;
(6)E的同分异构体:a含苯环;b.与硝化甘油具有相同官能团说明含有-NO2结构;c.核磁共振氢谱有三组峰,说明含有三种类型氢原子,故结构简式为: ;
;
故答案为: ;
;
(7)参考合成路线,若以![]() 和
和 为原料,制备
为原料,制备 则要利用双烯合成,先由
则要利用双烯合成,先由![]() 制得
制得![]() ,再和
,再和![]() 合成
合成 ,故设计合成路线为:
,故设计合成路线为: ;
;
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】某同学用如图所示的实验装置研究气体X的性质。气体X的主要成分是氯气,其中还含有水蒸气。请回答下列问题:
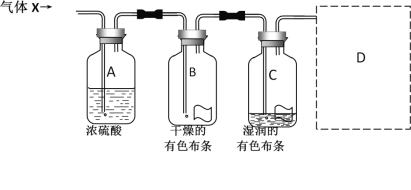
(1)该实验的主要目的是__________________________。
(2)与实验目的直接相关的实验现象是_________________________。
(3)图中所示的实验设计还存在不足。请根据相关物质的性质,在图中的D处画图补充有关实验装置和所用试剂。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)与氢气或与水在催化剂作用下的反应如下:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=-17kJ/mol;
H2S(g)+CO(g) △H1=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)两个反应在热力学上趋势均不大,其原因是:________________。
(2)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=_______。
H2(g)+CO2(g)的△H=_______。
(3)羰基硫、氢气、水蒸气共混体系初始投料比不变,提高羰基硫与水蒸气反应的选择性的关键因素是______。
(4)在充有催化剂的恒压密闭容器中只进行反应Ⅰ![]() 设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:
设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:

①m1______m2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②温度高于T0,COS转化率减小的可能原因为:i有副应发生;ii______;iii______。
(5)在充有催化剂的恒压密闭容器中进行反应Ⅱ.COS(g)与H2O(g)投料比分别为1:3和1:1,反应物的总物质的量相同时,COS(g)的平衡转化率与温度的关系曲线如图所示:
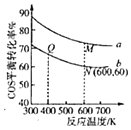
①M点对应的平衡常数______Q点![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;
②N点对应的平衡混合气中COS(g)物质的量分数为______;
③M点和Q点对应的平衡混合气体的总物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O![]() NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是
NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是

A. 曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+
B. 曲线Ⅰ与曲线II相交点对应pH=6.85
C. 0.1 mol ·L-1H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-)
D. 乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-
[H3NCH2CH2NH3]2++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图 ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________.
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 正盐
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的电离平衡常数K=___________________;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。

以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(1)对青蒿干燥破碎后,加入乙醚的目的是______。
(2)操作Ⅰ需要的玻璃仪器主要有烧杯、______,操作Ⅱ的名称是______。
(3)操作Ⅲ的主要过程可能是______(填字母)。
A. 加水溶解,蒸发浓缩、冷却结晶B. 加95%的乙醇,浓缩、结晶、过滤C. 加入乙醚进行萃取分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com