
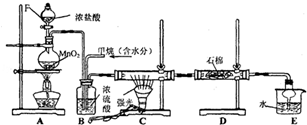
分析 (1)二氧化锰与浓盐酸在加热条件制备氯气;
(2)甲烷与氯气在光照条件下发生取代反应;
(3)浓硫酸具有吸水性,可以干燥氯气和氯化氢;
(4)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,三种取代物都不溶于水;
(5)氯气与甲烷反应生成产物中氯化氢、一氯甲烷为气体,其余为液态.
解答 解:(1)二氧化锰与浓盐酸在加热条件反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)甲烷与氯气在光照条件下发生取代反应,第一步反应生成一氯甲烷和氯化氢,化学方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(3)浓硫酸具有吸水性,可以干燥氯气和氯化氢,所以B装置还能用来干燥混合气体,故答案为:干燥混合气体;
(4)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,
故答案为:分液;
(5)甲烷与氯气发生取代反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,故选AB.
点评 本题考查甲烷和氯气的取代反应、氯气的实验室制法,明确甲烷发生取代反应的原理及得到氯代烷的性质是解题关键,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
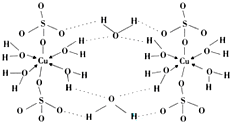 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3COOC2H5 | C. | CH3COOH | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、苯酚、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 苯酚、硫氰化钾溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-=H2O | |
| B. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | Na2SO3溶液中加入稀硝酸:SO32-+2H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 按要求回答下列各题:
按要求回答下列各题:
 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池中,锌电极是负极 | |
| B. | 手机上用的锂离子电池属于二次电池 | |
| C. | 甲烷燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com