
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法正确的是
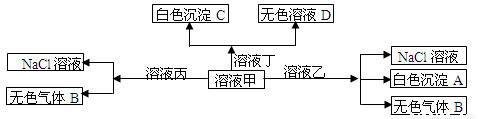
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42—
C.在甲中滴加丁开始反应的离子方程式:HCO3—+ Ba2++OH—= BaCO3↓+ H2O。
D.白色沉淀A可能溶解在溶液D中。
D
【解析】
试题分析:甲溶液能和乙溶液生成沉淀A,气体B和氯化钠,这说明该反应应该是铝离子和HCO3-之间水解相互促进的反应,即Al3+和HCO3-生成的气体B为二氧化碳,沉淀A为氢氧化铝。依据甲与丙生成气体B和氯化钠,则甲为NaHCO3,乙为AlCl3,丙是氯化氢。甲与丁生成白色沉淀,则丁含有钡离子且与甲生成沉淀,则丁为氢氧化钡。则A、依据以上分析可知甲应为碳酸氢钠,A错误;B、丙为HCl,含有H+,在酸性溶液中Fe2+、NO3-发生氧化还原反应,不能大量共存,B错误;C、向碳酸氢钠溶液中滴加氢氧化钡,开始碳酸氢钠过量,反应的离子方程式为2HCO3—+ Ba2++2OH—=CO32-+BaCO3↓+2H2O,C错误;D、白色沉淀A为氢氧化铝,属于两性氢氧化物,能溶于强碱氢氧化钡溶液中,D正确,答案选D。
考点:考查离子共存与离子检验的有关判断


科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用均正确的是
A.工业上分别用电解氧化镁和氧化铝的方法制备镁和铝
B.铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水
C.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
D.用二氧化硫加工银耳,使之更白
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:选择题
生活中处处有化学,下列有关说法正确的是
A.糖类、蛋白质、脂肪都是人类需要的营养物质
B.饮用矿泉水瓶、一次性水杯的主要成分是聚氯乙烯
C.冬天用纯甘油涂抹在手和面部可以防止皮肤干燥和开裂
D.大米富含淀粉,大米煮成粥后淀粉变成了葡萄糖
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
A.0.3 mol NO2、0.1 mol NO B.0.3 mol NO、0.1 mol NO2
C.0.6 mol NO D.0.3 mol NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2— 形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题
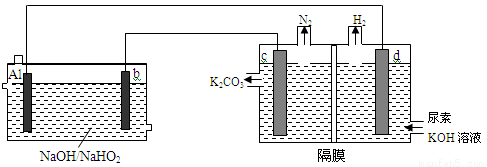
电极b是 极,电极反应式为 ,
(2)右池是 池,电极c的电极反应式为 ,
(3)通电2min后,Al电极质量减轻2.7g,则产生氮气的体积为 。(标准状况)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li 被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6 LiCoO2+C6,下列说法正确的是
LiCoO2+C6,下列说法正确的是
A.充电时,电池的阳极反应为LiC6 — e— = Li+ + C6
B.放电时,电池的正极反应为 CoO2 +Li++ e— = LiCoO2
C.乙酸、乙醇等含活泼氢的有机物可做该锂离子电池的电解质
D.该锂离子电池的比能量(消耗单位质量电极所释放的电量)比铅蓄电池低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
下列各组物质中,按熔点由高到低的顺序排列正确的是
A.H2O、H2S、H2Se B.Hg、Na、NaCl
C.晶体硅、金刚石、碳化硅 D.S、Br2、O3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16 mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)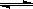 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数比原平衡大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com