
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、同质量、不同密度的N2和CO |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的N2O和CO2气体 |
| D、同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、Zn |
| C、Fe |
| D、NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
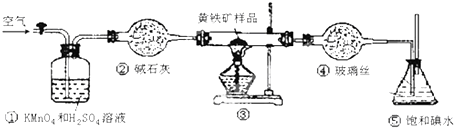
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
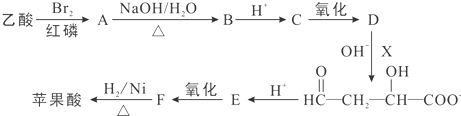
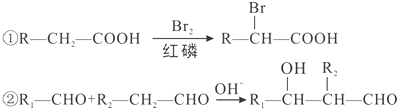
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视 |
| B、滴定前锥形瓶内含有少量水 |
| C、滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D、碱式滴定管用蒸馏水洗净后,直接装入已知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验步骤 | 实验现象 |
| ① | 取样,将其置于大试管中,加入一定量水,静置片刻 | 上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② | 取少量中层液体滴加无色酚酞试液 | 无色酚酞试液变红 |
| ③ | 另取少量中层液体进行焰色反应 | 火焰呈现砖红色 |
| ④ | 取少量黄色固体灼烧 | 燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ | 向下层白色固体中滴加足量稀盐酸 | 固体完全溶解,但仅产生少量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
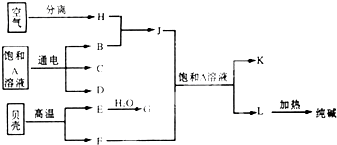 以海水中常见的物质A为原料可以发展很多种工业,如图中包含了几种基本工业生产,请根据各物质之间的转化关系.回答下列问题:
以海水中常见的物质A为原料可以发展很多种工业,如图中包含了几种基本工业生产,请根据各物质之间的转化关系.回答下列问题:| 水 |
| 溶解 |
| 过量BaCl2溶液 |
| 过滤 |
| 水 |
| 洗涤 |
| 低温烘干、冷却、称重 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com