
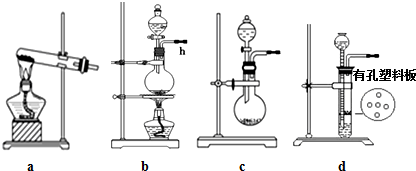
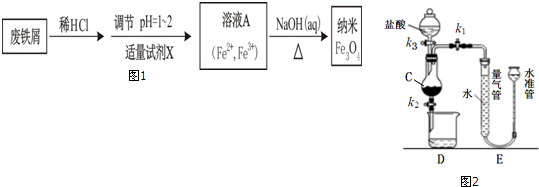
分析 (1)a装置是大试管加热制备气体,适合固体和固体混合加热制备气体,气体制备前需要检查装置的气密性;
(2)用c装置可制取NH3、O2和NO.,适用于固体和液体混合溶剂或反应放热得到气体,要制取NH3,可以利用固体氢氧化钠、氧化钙或碱石灰等中滴入浓氨水得到氨气,若以双氧水为原料制取O2,需要把过氧化氢加入固体二氧化锰催化快速分解生成氧气;
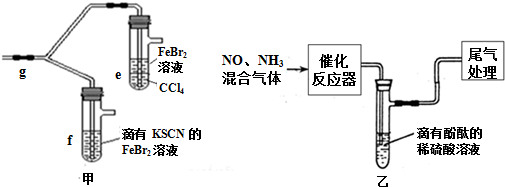
(3)氯气有毒不能直接排空,要用碱液吸收尾气;打开活塞a,向圆底烧瓶中滴入适量浓盐酸,然后关闭活塞a,点燃酒精灯加热;亚铁离子的还原性比溴离子强,氯气首先氧化亚铁离子,再氧化溴离子,氧化剂氧化性大于氧化产物;
(4)催化剂变反应速率不改变化学平衡,可以缩短达到平衡的时间.
解答 解:(1)a装置是大试管加热制备气体,适合固体和固体混合加热制备气体,如氨气、氧气、甲烷等气体制备可以在装置a中制备,.用d装置制取H2时,在加入药品之前要进行的操作是需要检查装置的气密性,
故答案为:氨气、氧气、甲烷等,检查装置的气密性;
(2)用c装置可制取NH3、O2和NO.,适用于固体和液体混合溶剂或反应放热得到气体,要制取NH3,可以利用固体氢氧化钠、氧化钙或碱石灰等中滴入浓氨水得到氨气,若以双氧水为原料制取O2,需要把过氧化氢加入固体二氧化锰催化快速分解生成氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,
故答案为:生石灰、碱石灰、NaOH、烧碱等,2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
(3)由于氯气有毒,直接排放到空气中会污染大气,要用碱液吸收尾气,实验装置缺少尾气处理装置,打开活塞a,向圆底烧瓶中滴入适量浓盐酸,然后关闭活塞a,点燃酒精灯加热;亚铁离子的还原性比溴离子强,氯气首先氧化亚铁离子,再氧化溴离子,所以e中水层溶液变黄,振荡后CCl4层无明显变化,说明通入的氯气只氧化亚铁离子,f中只氧化亚铁离子生成铁离子遇到KSCN溶液生成血红色溶液,由此可得出Cl2、Br2、Fe3+氧化性由强至弱的顺序是 Cl2>Br2>Fe3+,
故答案为:缺少尾气处理装置,溶液变为红色,Cl2>Br2>Fe3+;
(4)要比较不同催化剂的催化效果,应观察试管中溶液颜色的变化,为此需要测量并记录的是试管中溶液变红色所需时间,
故答案为:试管中溶液变红色所需时间.
点评 本题考查了性质实验方案设计,明确反应原理是解本题关键,结合资料分析解答,会根据离子反应方程式判断氧化性强弱,会根据实验现象确定发生的反应,难度中等.


科目:高中化学 来源: 题型:选择题
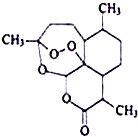 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素易溶于苯,难溶于水 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素的同分异构体不可能有芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①知H2O2的氧化性比Fe3+强,由反应②知H2O2的还原性比Fe2+强 | |
| B. | 在反应①、②中H2O2均作氧化剂被还原 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.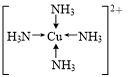 (写在方框内).
(写在方框内).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都比较稳定,久置不变浑浊 | B. | 相同的颜色 | ||
| C. | 有丁达尔现象 | D. | 加盐酸先产生沉淀,后沉淀溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com