
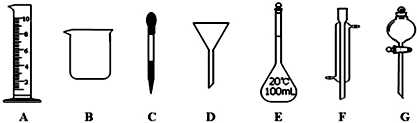
分析 (1)根据仪器的外形来分析;
(2)仪器G是分液漏斗,用于分液;
(3)①容量瓶在使用前要检查是否漏液,只能用于溶液的配制,不能用于溶解固体、稀释溶液和做反应容器;
②根据溶液稀释定律C浓V浓=C稀V稀来计算,取用一定体积的溶液用胶头滴管和量筒.
解答 解:(1)根据仪器的外形可知,C为胶头滴管,G为分液漏斗,故答案为:胶头滴管,分液漏斗;
(2)仪器G是分液漏斗,用于分液,即用于分离互不相溶的液体混合物,故选b;
(3)①a.容量瓶在使用前要检查是否漏液,故a错误;
b.使用前不必烘干,容量瓶中有水对浓度无影响,故b错误;
c.容量瓶不能受热,故不能用作物质反应或溶解的容器,故c错误;
d.容量瓶不能受热,故热溶液不可直接转移到容量瓶中,故d正确.
故选d.
②由于实验室无95mL容量瓶,故应选用100mL容量瓶,配制出100mL溶液,设需要的浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:10mol/L×VmL=0.5mol/L×100mL,解得V=5.0mL,而取用一定体积的溶液所用的仪器为胶头滴管和量筒,故答案为:5.0,C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和仪器的使用,属于基础型题目,难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向次氯酸溶液中滴加NaOH溶液:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2、NO、O2 | B. | 肯定没有C12、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性的强弱 | |
| B. | 最高价氧化物对应的水化物酸性的强弱 | |
| C. | 单质沸点的高低 | |
| D. | 单质与氢气化合的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某H2S04溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×l0-8,由水电离出的c(H+)=1×10-11 mol•L-1 | |
| B. | 将0.02 mol.L-1 HCI溶液与0.02 mol•L-l Ba( OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 将一定体积稀盐酸与稀氨水混合,当溶质为NH3•H20和NH4Cl时,溶液的pH≥7 | |
| D. | 向0.1 mol•L-1 Na2C03溶液中逐滴滴加0.1 mol•L-1稀盐酸,溶液中c(HCO3-)先增大后减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com