
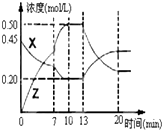
 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,| 0.9×0.9 |
| 1.2×1.5 |


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
| A、①③④ | B、①③④⑥ |
| C、①②④ | D、②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg Al合金 |
| B、黄铜(Cu Zn合金) |
| C、Na K合金 |
| D、生铁(Fe C合金) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) 浓度(mol?L-1) | 0 | 5 | 10 | 15 | 20 | 25 |
| NO | 1.00 | 0.60 | 0.40 | 0.40 | 0.52 | 0.52 |
| N2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
| CO2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
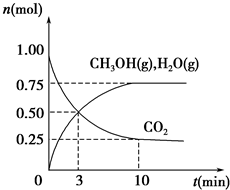 如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.
如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.温度(K) CO2转化率/(%)
| 500 | 600 | 700 | 800 | ||
| 1.5 | 45 | 33 | 20 | 12 | ||
| 2 | 60 | 43 | 28 | 15 | ||
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
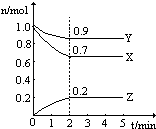 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据:
(1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据:| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com