
| 4.0×10-14 |
| 10-11 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
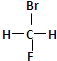 和
和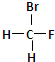 ②1H-、2H、3H+、D2 ③淀粉和纤维素 ④
②1H-、2H、3H+、D2 ③淀粉和纤维素 ④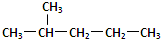 和
和 ⑤16O2、18O3 ⑥235U、238U
⑤16O2、18O3 ⑥235U、238U查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| H | + |
| H | + |
| H | + |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯的分子是环状结构,属于烷烃 |
B、 表示苯的分子结构,其中含有碳碳单键、双键 表示苯的分子结构,其中含有碳碳单键、双键 |
| C、苯的分子式为C6H6,分子中碳原子远远没有饱和,因此,能与溴水反应 |
| D、苯不使酸性高锰酸钾褪色,说明苯分子中不含碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、在101kPa时,2gH2完全燃料生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ?mol-1 |
| C、由C(石墨,s)=C(金刚石,s)△H=+1.90kJ/mol可知,金刚石比石墨稳定 |
| D、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol可知,若将含1molCH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com