
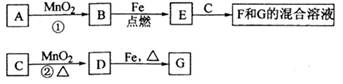
 2H2O + O2↑;KClO3
2H2O + O2↑;KClO3 MnCl2+ Cl2↑+ 2H2O
MnCl2+ Cl2↑+ 2H2O  2H2O + O2↑;若只能在加热情况下进行,则反应物A应为KClO3。
2H2O + O2↑;若只能在加热情况下进行,则反应物A应为KClO3。 MnCl2+ Cl2↑+ 2H2O。
MnCl2+ Cl2↑+ 2H2O。

科目:高中化学 来源:不详 题型:多选题
| A.铁红可用作红色涂料 |
| B.小苏打可用于治疗胃酸过多 |
| C.铁是地壳中含量最多的金属元素 |
| D.高压钠灯透雾性强,可用于公路两旁的照明灯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
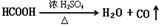 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
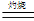 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.产物中硝酸铜的物质的量为0.025 mol |
| B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol |
| C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol |
| D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Zn2+ | 5. 9 | 8. 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 |
| B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
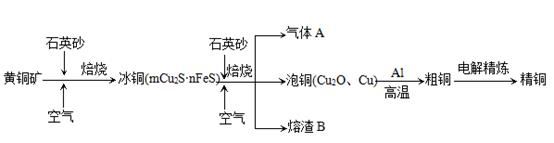
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
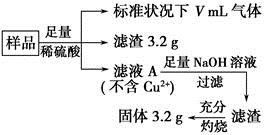
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B.样品中Fe元素的质量为2.24 g |
| C.样品中CuO的质量为4.0 g |
| D.V=896 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该浅绿色溶液中含有Fe2+,在空气中被氧化为Fe3+ |
| B.欲检验该黄色溶液中是否含有未被氧化的Fe2+,向其中滴加KSCN溶液 |
| C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化 |
| D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com