

分析 ①根据仪器的图形判断仪器的种类;
②泥沙不溶于水,可用过滤的方法分离,花生油不溶于水,可用分液的方法分离.
解答 解:①A仪器是蒸馏烧瓶,用于蒸馏实验;B仪器是漏斗,用于过滤实验;C仪 器是分液漏斗,用于萃取分液实验;D仪器是蒸发皿,用于蒸发实验;E仪器是冷凝管,用于蒸馏实验,故答案为:蒸馏烧瓶;分液漏斗;冷凝管;
②粗盐和泥沙必须通过溶解过滤除去泥沙,再蒸发结晶得到食盐,要用到漏斗和蒸发皿,故选BD;花生油和水不互溶的两种液体,用分液的方法分离,可选用分液漏斗,故选C.
故答案为:BD;C.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及操作的原理、方法,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;元素C的原子组成符号是2713Al.
;元素C的原子组成符号是2713Al.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 | |
| C. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 | |
| D. | 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
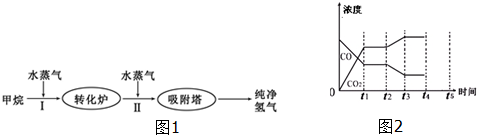
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

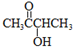 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
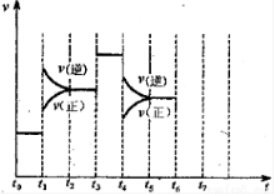
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com