
【题目】在密闭容器中发生如下反应: aX(g) + bY(g) cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
A. 平衡向逆反应方向移动 B. a + b < c + d
C. Z的体积分数增加 D. X的转化率下降
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)将饱和三氯化铁溶液滴入沸水中,直到液体变为色,得到的分散系中分散质粒子的直径大小在之间,用此分散系进行实验:
(2)将其装入U型管内,用石墨做电极,接通直流电源,通电一段时间后发现阴极附近颜色逐渐变深,原因是 , 这种现象称为 .
(3)用于提纯此分散系中相应离子的方法叫 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
A.54%
B.63%
C.9%
D.12%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合金A由两种常见金属组成.为测定其组成,某同学的实验流程如图所示: 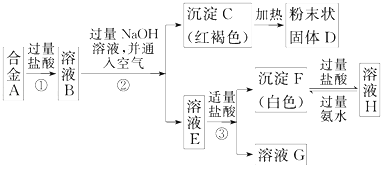
请回答:
(1)过程②中分离C和E的化学实验基本操作是;
(2)溶液H中所含的阳离子有(用离子符号表示);
(3)合金A与D在高温下反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴藏着丰富的资源。下列有关海水综合利用的说法中,不正确的是 ( )
A. 从海水中可提取食盐
B. 海水蒸馏可得淡水
C. 直接电解海水可得镁
D. 从海水中得到淡水的方法有蒸馏法、电渗析法、离子交换法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如图所示),其特殊的电子结构将有望广泛应用于电子材料领域.下列说法不正确的是( ) 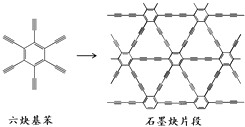
A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是
;
实验二:制取水合肼(实验装置如图所示)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充 分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.(已知:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是(填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气.测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液.
b.移取25.00mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右.记录消耗碘的标准液的体积.
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4H2O)的质量分数为(保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: . 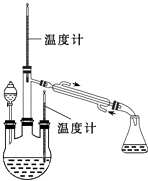
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com