
| A. | 0.1Lmol.L-1的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) | |
| B. | 醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) | |
| C. | 将pH=5的H2SO4溶液稀释1×103倍后,c(H+):c(SO42-)=2:1 | |
| D. | 常温下,pH=4的NaHC2O4溶液中:c(C2O42-)<c(H2C2O4) |
分析 A.根据硫酸铵溶液中的电荷守恒判断;
B.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(CH3COO-)=c(Na+),则c(CH3COO-)+c(CH3COOH)>c(Na+);
C.pH=5的H2SO4溶液中氢离子浓度为10-5mol/L,则硫酸根离子浓度为5×10-6mol/L,硫酸溶液稀释后溶液仍然为酸性,氢离子浓度只能接近10-7mol/L;
D.常温下,pH=4的NaHC2O4溶液中,HC2O4-的电离程度大于其水解程度.
解答 解:A.0.1Lmol.L-1的硫酸铵溶液中,根据电荷守恒可知:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)+c(H+)>c(SO42-)+c(OH-),故A正确;
B.醋酸与醋酸钠的pH=7的混合溶液中:则c(H+)=c(OH-),根据电荷守恒可知c(CH3COO-)=c(Na+),则c(CH3COO-)+c(CH3COOH)>c(Na+),故B错误;
C.pH=5的H2SO4溶液中氢离子浓度为10-5mol/L,则硫酸根离子浓度为5×10-6mol/L,稀释过程中硫酸的物质的量不变,则稀释后硫酸根离子的浓度为5×10-9mol/L;
硫酸溶液稀释后溶液仍然为酸性,氢离子浓度只能接近10-7mol/L,所以稀释后c(H+):c(SO42-)=10-7mol/L:5×10-9mol/L=20:1,故C错误;
D.常温下,NaHC2O4溶液的pH=4,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,C为易错点,注意硫酸溶液稀释后不可能变为碱性溶液.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活泼的金属粉尘遇明火均易引起爆炸 | |
| B. | 任何金属粉末在不正确操作下均可能引起爆炸 | |
| C. | 汽车轮毂表面镀铝既增加美观度,又耐腐蚀 | |
| D. | 事故告诫人们安全生产,防污、防爆非常重要 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S在反应中既是氧化剂又是还原剂 | |
| B. | 以上反应中转移电子的物质的量为1 mol | |
| C. | 以上参加反应的HNO3中被还原的HNO3为2 mol | |
| D. | 反应中,氧化剂和还原剂的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
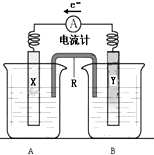 如图是铜锌原电池装置.其电池的总反应是:
如图是铜锌原电池装置.其电池的总反应是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生在实验室测定一未知浓度的稀盐酸,已知25℃时,在20ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知25℃时,在20ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积 | 19.00 | 21.81 | 21.79 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com